-
化学与生产、生活、社会密切相关,下列有关说法不正确的是( )
A.绿色荧光蛋白质(GFP)是高分子化合物,其水溶液有丁达尔效应
B.世博停车场安装催化光解设施,可将汽车尾气中的CO和NOx反应生成无毒物质
C.绿色化学的核心是应用化学原理对环境污染进行治理
D.高容量的储氢材料研究是推广应用氢氧燃料电池的关键问题之一难度: 中等查看答案及解析
-
氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应,用CuSO4溶液和“某物质”在40-50℃时反应可产生它.下列有关叙述中错误的是( )
A.这“某物质”具有还原性
B.CuH与盐酸反应,可能产生H2
C.CuH与足量的稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O
D.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl难度: 中等查看答案及解析
-
下列说法错误的是( )
A.如果设“此”为电解质,“彼”为非电解质,不是所有的物质都是非此即彼的
B.硅便于运输、贮存,燃烧放出的热量大,将是“21世纪的最佳能源”
C.相同温度下,同一化学反应的化学计量系数不同,平衡常数的值可能也不同
D.在迄今发现的元素中,不一定所有非金属元素(稀有气体除外)都满足条件“主族元素的族序数≥其周期序数”难度: 中等查看答案及解析
-
下列对化学用语的理解正确的是( )
A.原子结构示意图可以表示12C原子或13C原子
B.比例模型可以表示CO2分子或SiO2分子
C.电子式可以表示羟基或氢氧根离子
D.离子方程式H++OH-=H2O:表示盐酸和NaOH溶液的反应,也可以表示醋酸和氨水的反应难度: 中等查看答案及解析
-
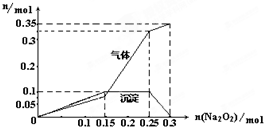
以NA 表示阿伏加德罗常数,下列说法正确的是( )
A.T℃时,1 L pH=6纯水中,含10-8NA个OH-
B.15.6 g Na2O2 与过量CO2反应时,转移的电子数为0.4NA
C.1 mol SiO2中含有2 mol Si-O单键
D.14g分子式为CnH2n的(n≥2)链烃中含有的C=C的数目一定为NA/n难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.乙醇和甘油互为同系物
B.分子式为C7H8O且分子中有苯环的有机物共有4种
C.苯乙烯分子中所有原子可能在同一个平面上
D.除去乙烯中混有的甲烷,可将混合气体通过酸性高锰酸钾溶液难度: 中等查看答案及解析
-
实验室需配制一种仅含五种离子(水电离出的离子可忽略)的混合溶液,且在混合溶液中五种离子的物质的量浓度均为1mol/L,下面四个选项中能达到此目的是( )
A.Ca2+、K+、OH-、Cl-、NO3-
B.Fe2+、H+、Br-、NO3-、Cl-
C.Na+、K+、SO42-、NO3-、Cl-
D.Al3+、Na+、Cl-、SO42-、NO3-难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1
B.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:
N2(g)+3H2(g)2NH3(g)△H=-38.6 kJ•mol-1
C.相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量
D.常温下,反应C(s)+CO2(g)═2CO(g)不能自发进行,则该反应的△H>0难度: 中等查看答案及解析
-
下列离子方程式书写不正确的是( )
A.NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时:4OH-+3SO2=SO32-+2HSO3-+H2O
B.酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O=3I2+6OH-
C.AgNO3溶液中加入过量的氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O
D.1 mol•L-1的NaAlO2溶液和2.5 mol•L-1的HCl等体积互相均匀混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O难度: 中等查看答案及解析
-
下列各组中的反应,属于同一反应类型的是( )
A.乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷
B.乙醇和氧气制乙醛;葡萄糖与新制的氢氧化铜共热
C.蔗糖与稀硫酸共热;苯和氢气制环己烷
D.乙醇制乙烯;苯的硝化反应难度: 中等查看答案及解析
-
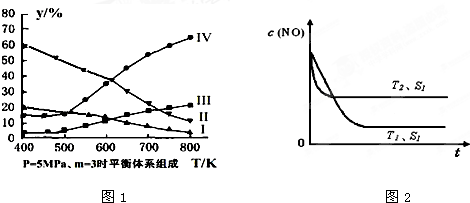
氧族元素包括氧、硫、硒、碲、钋等,如图为氧族元素氢化物a、b、c、d的生成热数据示意图,下列关于氧族元素的说明正确的( )
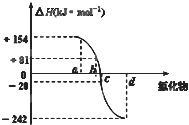
A.含有18e-的两种氢化物中只存在极性键
B.氢化物的沸点大小是H2O<H2S<H2Se<H2Te
C.a所对应的氢化物是H2O
D.每1mol H2S分解会吸收20KJ的热量难度: 中等查看答案及解析
-
著名化学家徐光宪获得2008年度“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献.稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应.已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+. 下列说法正确的是( )
A.铈(Ce)元素在自然界中主要以单质形式存在
B.铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑
C.用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++2Fe2+=Ce3++2Fe3+
D.四种稳定的核素、
、
、
,它们互称为同位素
难度: 中等查看答案及解析
-
X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X 与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76g•L -1,W在短周期主族元素中原子半径最大.下列说法正确的是( )
A.原子半径:W>Y>X
B.元素X与M形成化合物的空间构型可以是正四面体型、直线型或平面型等
C.将X Z2通入W单质与水反应后的溶液中,生成的盐一定只有一种
D.Y元素的含氧酸都属于强酸难度: 中等查看答案及解析
-
T1℃时,向容积为2L的密闭容器中冲入一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),反应过程测定的部分数据如表:
下列说法正确的是( )反应时间/min n(CO)/mol n(H2O)/mol 1.20 0.60 10 0.80 20 0.20
A.反应在10min内的平均速率为v(H2)=0.04mol•L-1•min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.温度升高至T2℃(T2>T1)时,上述反应平衡常数为0.64,则正反应为吸热反应难度: 中等查看答案及解析
-
在T℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g•cm-3,溶质的质量分数为w,其中含NH3的物质的量为b mol.下列叙述中正确的是( )
A.溶质的质量分数为w=×100%
B.溶质的物质的量浓度c=mol•L-1
C.溶液中c(OH-)=mol•L-1
D.上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w难度: 中等查看答案及解析
-
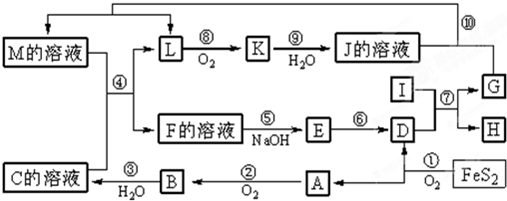
部分氧化的Fe-Cu合金样品(氧化物为Fe2O3、CuO)共5.76g,经如下处理:

下列说法正确的是( )
A.V=448
B.V=224
C.样品中CuO的质量为4.0g
D.滤液A中的阳离子为Fe2+、Fe3+、H+难度: 中等查看答案及解析