-
某溶液既能溶解Al(OH)3,又能溶解H2SiO3,在该溶液中可以大量共存的离子组是( )
A.K+、Na+、HCO3-、NO3-
B.Na+、SO42-、Cl-、ClO-
C.H+、Mg2+、SO42-、NO3-
D.Ag+、K+、NO3-、Na+难度: 中等查看答案及解析
-
下列除去杂质的实验方法正确的是( )
A.除去CO中少量O2:通过灼热的Cu网后收集气体
B.除去K2CO3固体中少量NaHCO3:置于坩埚中加热
C.除去Al3+溶液中的少量Fe3+:加入过量氨水后过滤
D.除去FeCl3酸性溶液中少量的FeCl2:加入稍过量双氧水后放置难度: 中等查看答案及解析
-
目前人类已发现的非金属元素除稀有气体外共有16种,下列是对这16种非金属元素的相关判断:①都是主族元素,最外层电子数都大于4;②单质在反应中都只能作氧化剂;③氢化物常温下都是气态,所以又都叫气态氢化物;④单质形成的晶体都为分子晶体;⑤氧化物常温下都可以与水反应生成酸.正确的是( )
A.只有①②正确
B.只有①③正确
C.只有④正确
D.①②③④⑤均不正确难度: 中等查看答案及解析
-
下列叙述不正确的是( )
A.液氯泄漏事故时,附近人员应迅速远离液氯泄漏地点,并逆风往安全区域疏散
B.水的沸点比硫化氢高,主要原因是水分子间能形成氢键
C.反应AgCl+NaBr=AgBr+NaCl能在水溶液中进行,是因为AgBr比AgCl更难溶于水
D.常温下浓硫酸可贮存于铁制或铝制容器中,说明常温下铁和铝与浓硫酸不反应难度: 中等查看答案及解析
-
下列关于Cl、N、S等非金属元素化合物的说法正确的是( )
A.漂白粉的成分是次氯酸钙
B.实验室可用浓硫酸干燥氨气
C.实验室可用NaOH 处理Cl2 和HCl 废气
D.Al2(SO4)3 可除去碱性废水及酸性废水中的悬浮颗粒难度: 中等查看答案及解析
-
研究反应物的化学计量数与产物之间的关系时,使用类似数轴的方法可以收到直观形象的效果.下列表达不正确的是( )
A.密闭容器中CuO和C高温反应的气体产物: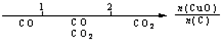
B.Fe在Cl2中的燃烧产物:
C.AlCl3溶液中滴加NaOH后铝元素的存在形式:
D.氨水与SO2反应后溶液中的铵盐:
难度: 中等查看答案及解析
-
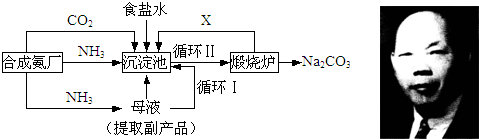
在pH为4-5的环境中,Cu2+和Fe2+不水解,而Fe3+几乎完全水解.工业上制CuCl2是将浓盐酸用蒸汽加热到80℃左右.在漫漫加入粗氧化铜(含杂质FeO),充分搅拌使之溶解.欲除去所得CuCl2溶液中的杂质离子,下列方法中可行的是( )
A.加入HNO3将Fe2+氧化成Fe3+,再加水稀释至pH4-5
B.向溶液中通入Cl2,再加入CuO粉末调节至pH4-5
C.向溶液中通入Cl2,在通入NH3调节至pH4-5
D.向溶液中通入H2O2,再加入CuO粉末调节至pH4-5难度: 中等查看答案及解析
-
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z.下列叙述正确的是( )
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔、沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物难度: 中等查看答案及解析