-
在日常生活中,下列解决问题的方法不可行的是
A.为加快漂白精的漂白速率,使用时可滴加几滴醋酸
B.为防止海鲜腐烂,可将海鲜产品浸泡在硫酸铜溶液中
C.为增强治疗缺铁性贫血效果,可在口服硫酸亚铁片时同服维生素C
D.为使水果保鲜,可在水果箱内放入高锰酸钾溶液浸泡过的硅藻土
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.液溴应保存于带磨口玻璃塞的广口试剂瓶中,并加水“水封”以减少其易挥发
B.向Ca(ClO)2溶液通入CO2,溶液变浑浊,再加入品红溶液,红色褪去
C.滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口,试纸不变蓝,原溶液中无NH4+
D.氨气是一种碱性气体,可用P2O5或无水CaCl2干燥
难度: 中等查看答案及解析
-
下列变化的实质相似的是
①浓硫酸能在白纸上写字,氢氟酸能在玻璃上刻字
②二氧化硫和氧气均能使品红溶液褪色
③二氧化硫能使高锰酸钾溶液、溴水褪色
④氨气和碘化氢气体均不能用浓硫酸干燥
⑤常温下浓硫酸可用铁容器存放、加热条件下浓硫酸能与木炭反应
⑥浓硫酸和浓盐酸在空气中敞口放置时浓度均减小
A.②③④ B.③⑤ C.③④⑥ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
NA表示阿伏伽德罗常数的值,则下列说法正确的是
A.78gNa2O2固体含有的离子数为4NA
B.22.4L乙烯中含有的分子数为NA
C.用惰性电极电解NaCl溶液,每生成agNaOH时,电路中通过的电子个数为aNA
D.1molSiO2晶体中Si—O键数为4NA
难度: 困难查看答案及解析
-
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO和Cu(NO3)2,在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是
A.Cu与Cu2O 的物质的量之比为2:1
B.硝酸的物质的量浓度为2.6mol/L
C.产生的NO在标准状况下的体积为4.48L
D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol
难度: 困难查看答案及解析
-
下列图像均为实验过程中产生沉淀的物质的量(Y)与加入试剂的量(X)之间的关系图。则其中正确的是
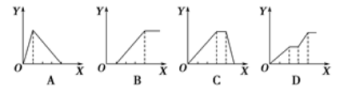
A.A图表示向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B.B图表示向NaAlO2溶液中逐滴滴加稀盐酸至过量且边滴边振荡
C.C图表示向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量
D.D图表示向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入二氧化碳至过量
难度: 困难查看答案及解析
-
下列有关离子方程式,正确的是
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-
NH3↑+CO32-+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
难度: 中等查看答案及解析