-
下列说法错误的是 ( )
A. 垃圾是放错了地方的资源
B. 低碳生活、节能减排,可减少温室气体排放
C. 工业盐NaNO2有咸味,也可以用来食品调味
D. 合理使用化肥,提高农作物产量,缓解粮食危机
难度: 简单查看答案及解析
-
归类是化学学习的一种重要方法,下列归类错误的是 ( )
选项
归 类
内 容
A
复合肥料
NH4HCO3 、KNO3 、 NH4H2PO4
B
由于空气污染造成的环境问题
雾霾、酸雨、臭氧层空洞
C
合成材料
塑料、合成纤维、合成橡胶
D
治疗胃酸过多的药物中可能含有的成份
Al(OH)3、NaHCO3、CaCO3
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列实验设计错误的是 ( )
A. 用电解水测定水的组成 B. 用碘酒检验淀粉
C. 用肥皂水区分硬水和软水 D. 用湿润的pH试纸测试稀盐酸的pH
难度: 简单查看答案及解析
-
下列对实验现象的描述正确的是
A. 红磷在空气中燃烧,产生大量白烟 B. 铁丝浸入稀盐酸,形成黄色溶液
C. 持续加热碳酸氢铵,最终有固体残留 D. 将浓硝酸滴入鸡蛋清,蛋清变黑
难度: 简单查看答案及解析
-
下列对物质用途描述错误的是( )
A. 用稀盐酸除铁锈 B. 用液态二氧化碳灭火器扑灭图书档案室的火灾
C. 用氮气作为灯泡填充气 D. 用烧碱消除面团发酵产生的酸味
难度: 简单查看答案及解析
-
下列实验设计能达到目的是 ( )
序号
实验内容
选用试剂
操 作
A
除去Cu粉中少量的Fe粉
稀硫酸
加入足量的稀硫酸充分应,过滤,蒸发
B
提纯含少量NaCl的KNO3固体
H2O
先加入水溶解,蒸发结晶
C
区分NH4HCO3和NH4Cl
稀盐酸
取样,加稀盐酸,观察是否有气泡产生
D
分离CO2和CO混合物
①NaOH溶液
②浓盐酸
先用①吸收掉CO2分离出CO,再向剩余溶液中加②,即可“释放”出纯净的CO2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列说法正确的是 ( )
A. 不饱和溶液转变成饱和溶液,溶质质量分数一定增大
B. 用水不能区分NaOH和NH4NO3两种固体,因为它们的水溶液都是无色的
C. 98%的浓硫酸与等体积的水混合,最终所得硫酸溶液中溶质质量分数大于49%
D. 向置于空气的氢氧化钠溶液中滴入酚酞试液,溶液变红,说明氢氧化钠溶液未变质
难度: 简单查看答案及解析
-
下列试剂可用于鉴定铁,铜,银的金属活泼性强弱的是
A. 硫酸锌溶液 B. 硝酸银溶液
C. 硫酸铜溶液 D. 稀盐酸
难度: 中等查看答案及解析
-
下列属于纯净物的是 ( )
A. 空气 B. 生铁 C. 牛奶 D. 水银
难度: 简单查看答案及解析
-
下列变化属于物理变化的是 ( )
A. 粮食霉变 B. 甘蔗榨汁 C. 干电池放电 D. 自来水消毒
难度: 简单查看答案及解析
-
下列说法相互对应的是( )
A. 化合价:
O B. 元素符号:氯﹣Al
C. 化学式:氧化铁﹣FeO D. 俗名:氢氧化钙﹣生石灰
难度: 简单查看答案及解析
-
下列排列顺序正确的是
A.
 ;
;B.
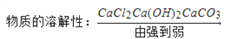 ;
;C.
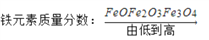
D.
 ;
;难度: 中等查看答案及解析
-
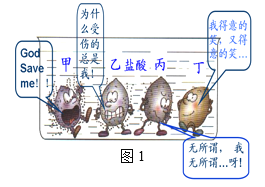
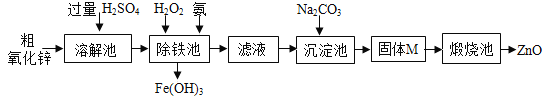
甲和乙可以制备化工原料丙,微观过程如下图。下列说法错误的是( )
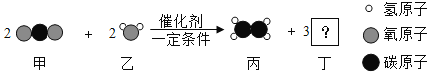
A. 丁的化学式为O2
B. 丙中C、H的质量比为12:1
C. 该反应体现无机物可转化为有机物
D. 若改变反应条件,甲和乙反应可生成一种重要的糖类物质
难度: 中等查看答案及解析
-
下列化学方程式正确的是( )
A. 铜片插入稀硫酸:Cu+H2SO4=CuSO4+H2↑
B. 工业炼铁:FexOy+yCO
xFe+yCO2
C. 氢氧化钠溶液吸收二氧化硫:2NaOH+SO2=Na2SO4+H2O
D. 二氧化碳通入氯化钙溶液:CO2+CaCl2+H2O=CaCO3↓+2HCl
难度: 简单查看答案及解析
-
在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A.
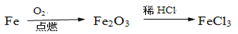
B.
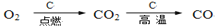
C.
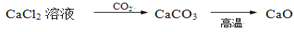
D.
难度: 中等查看答案及解析
-
在NaOH和Na2CO3的混合物9.3g中加入一定量的10.0%的稀盐酸,恰好完全反应, 将生成的气体全部通入足量的澄清石灰水中,产生5.0g沉淀。下列说法正确的是( )
A. 题中的一定量是7.3g
B. 反应共产生11.7gNaCl
C. 如用10%的稀盐酸将5.0g沉淀溶解,则所用稀盐酸的量与题中的一定量相等
D. Na2CO3消耗的稀盐酸比NaOH消耗的稀盐酸多
难度: 困难查看答案及解析
-
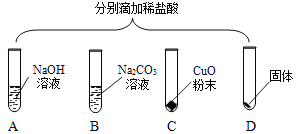
下列各组溶液,不用其他试剂就能鉴别的是
A. FeCl3 HCl NaOH KNO3
B. HCl K2CO3 CaCl2 BaCl2
C. MgSO4 BaCl2 CuSO4 Na2SO4
D. NH4Cl NaOH HCl Ca(OH)2
难度: 中等查看答案及解析
-
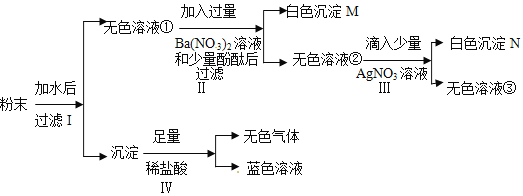
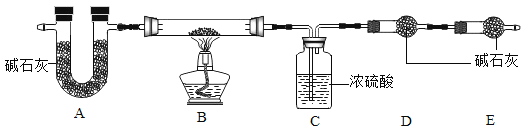
我国化工专家侯德榜创立了“侯氏制碱法”,促进了世界制碱技术的发展。流程简图如下(已知:母液中有一种铵态氮肥) ,下列有关说法不正确的是
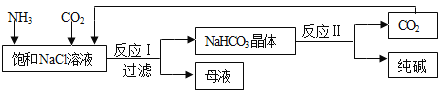
A. 反应中先通入氨气的目的是促进二氧化碳的吸收,提高产率
B. “母液”中至少含有两种溶质
C. 反应II得到的CO2可以循环使用
D. 反应I的方程式为NaCl+NH3+CO2=NaHCO3↓+NH4Cl
难度: 中等查看答案及解析
-
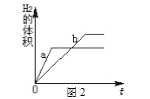
KCl和KNO3的溶解度表及溶解度曲线如下图所示,下列说法不正确的是
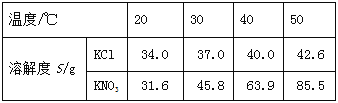
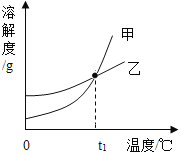
A. 甲表示KNO3溶解度曲线
B. 温度t1应在20℃~30℃之间
C. 40℃时,5gKCl加入10g水中,可得到33.3%的溶液
D. 50℃时,30g KNO3加入50g水,充分溶解,再降温到30℃,有晶体析出
难度: 中等查看答案及解析
-
烧杯中盛有CuCl2和HCl的混合溶液100g,向其中滴加10%的NaOH溶液,烧杯中溶液的质量与滴加溶液的质量关系如图所示。下列说法正确的是
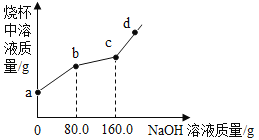
A. ab段反应产生蓝色沉淀
B. bc段溶液增加80g
C. c点对应的溶质质量分数为4.9%
D. d点溶液显碱性
难度: 中等查看答案及解析