-
下列有关物质性质的应用正确的是( )
A.液氨汽化时要吸收大量的热,可用作制冷剂
B.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
C.生石灰能与水反应,可用来干燥氯气
D.氯化铝是一种电解质,可用于电解法制铝难度: 中等查看答案及解析
-
燃料电池能有效提高能源利用率,具有广泛的应用前景.下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.甲醇
B.天然气
C.液化石油气
D.氢气难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.丙烯的结构简式:C3H6
B.氢氧根离子的电子式:
C.氯原子的结构示意图:
D.中子数为146、质子数为92 的铀(U)原子92238U难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.使甲基橙变红色的溶液:Mg2+、K+、SO42-、NO3-
B.使酚酞变红色的溶液:Na+、Cu2+、HCO3-、NO3-
C.0.1 mol•L-1AgNO3溶液:H+、K+、SO42-、I-
D.0.1 mol•L-1NaAlO2溶液:H+、Na+、Cl-、SO42-难度: 中等查看答案及解析
-
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作.下列图示对应的操作规范的是( )
A.
称量
B.
溶解
C.
转移
D.
定容难度: 中等查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:甲
乙
丙.下列有关物质的推断不正确的是( )
A.若甲为焦炭,则丁可能是O2
B.若甲为SO2,则丁可能是氨水
C.若甲为Fe,则丁可能是盐酸
D.若甲为NaOH 溶液,则丁可能是CO2难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1 L 1mol•L-1的NaClO溶液中含有ClO-的数目为NA
B.78 g 苯含有C=C 双键的数目为3NA
C.常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA
D.标准状况下,6.72 L NO2与水充分反应转移的电子数目为0.1NA难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.MnO2 与浓盐酸反应制Cl2:MnO2+4HClMn2++2Cl-+Cl2↑+2H2O
B.明矾溶于水产生Al(OH)3胶体:Al3++3H2O═Al(OH)3↓+3H+
C.Na2O2 溶于水产生O2:Na2O2+H2O═2Na++2OH-+O2↑
D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-═CaCO3↓+H2O难度: 中等查看答案及解析
-
Mg-、H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,示意图如下.该电池工作时,下列说法正确的是( )

A.Mg 电极是该电池的正极
B.H2O2在石墨电极上发生氧化反应
C.石墨电极附近溶液的pH 增大
D.溶液中Cl-向正极移动难度: 中等查看答案及解析
-
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13.X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素.下列说法正确的是( )
A.原子半径的大小顺序:r(Y)>r(Z)>r(W)
B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)═NH4Cl(s)在室温下可自发进行,则该反应的△H<0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH 溶液加水稀释后,溶液中的值减小
D.Na2CO3溶液中加入少量Ca(OH)2 固体,CO32-水解程度减小,溶液的pH 减小难度: 中等查看答案及解析
-
药物贝诺酯可由乙酰水杨酸和对乙酰氨基酚在一定条件下反应制得:
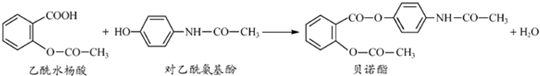
下列有关叙述正确的是( )
A.贝诺酯分子中有三种含氧官能团
B.可用FeCl3溶液区别乙酰水杨酸和对乙酰氨基酚
C.乙酰水杨酸和对乙酰氨基酚均能与NaHCO3溶液反应
D.贝诺酯与足量NaOH溶液共热,最终生成乙酰水杨酸钠和对乙酰氨基酚钠难度: 中等查看答案及解析
-
下列依据相关实验得出的结论正确的是( )
A.向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液一定是碳酸盐溶液
B.用铂丝蘸取少量某溶液进行焰色反应,火焰呈黄色,该溶液一定是钠盐溶液
C.将某气体通入溴水中,溴水颜色褪去,该气体一定是乙烯
D.向某溶液中滴加KSCN 溶液,溶液不变色,滴加氯水后溶液显红色,该溶液中一定含Fe2+难度: 中等查看答案及解析
-
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pc(CO32-)=-lg cc(CO32-).下列说法正确的是( )
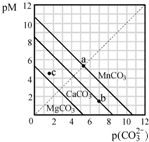
A.MgCO3、CaCO3、MnCO3的Ksp依次增大
B.a 点可表示MnCO3的饱和溶液,且c(Mn2+)=c(CO32-)
C.b 点可表示CaCO3的饱和溶液,且c(Ca2+)<c(CO32-)
D.c 点可表示MgCO3的不饱和溶液,且c(Mg2+)<c(CO32-)难度: 中等查看答案及解析
-
一定条件下存在反应:CO(g)+H2O(g)⇌CO2(g)+H2(g),其正反应放热.现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器I、II、III,在I中充入1mol CO和1mol H2O,在II中充入1mol CO2 和1mol H2,在III中充入2mol CO 和2mol H2O,700℃条件下开始反应.达到平衡时,下列说法正确的是( )
A.容器I、II中正反应速率相同
B.容器I、III中反应的平衡常数相同
C.容器I中CO 的物质的量比容器II中的多
D.容器I中CO 的转化率与容器II中CO2的转化率之和小于1难度: 中等查看答案及解析

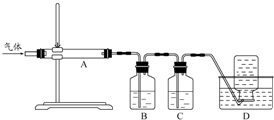
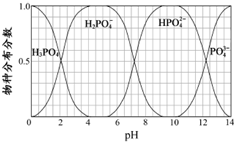
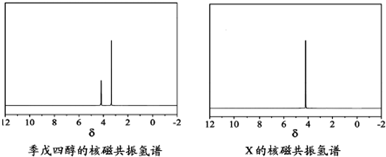
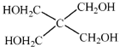 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.