-
“化学,我们的生活,我们的未来”曾经是2011年“国际化学年”的主题。你认为下列行为中,不符合这一主题的是
A.控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源
B.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展
C.开发太阳能、水能、风能等新能源、减少使用煤、石油等化石燃料
D.实现资源的“3R”利用,即:减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle)
难度: 中等查看答案及解析
-
下列物质与其用途完全符合的有( )条
①Na2CO3—制玻璃;②SiO2—太阳能电池;③干冰—人工降雨;④NaCl—制纯碱;⑤Al2O3—焊接钢轨;⑥NaClO—消毒剂;⑦Fe2O3—红色油漆或涂料;⑧Al2O3—耐火材料
A.4 B.5 C.6 D.7
难度: 简单查看答案及解析
-
为使Fe2+,Fe3+,Zn2+较完全地形成氢氧化物沉淀,溶液的酸碱度分别为pH7.7、 pH4.5、pH6.6。某硫酸锌酸性溶液中含有少量Fe2+,Fe3+杂质离子,为除去这些离子制得纯净的ZnSO4,应加入的试剂是
A.H2O2,ZnO B.氨水 C.KMnO4,ZnCO3 D.NaOH溶液
难度: 中等查看答案及解析
-
下列各组离子在指定溶液中能大量共存的是
A.常温下,呈碱性的溶液:K+、AlO2-、CO32-、Na+
B.含Fe3+的溶液中:K+、NH4+、Cl-、I-
C.中性溶液:Fe3+、Al3+、NO3-、SO42-
D.无色溶液中:K+、AlO2-、NO3-、HCO3-
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.1 molCl2与足量Fe反应转移电子数一定为3NA
B.标准状况下,2.24 L NH3中含有共价键的数目为NA
C.1 mol Na2O和Na2O2混合物中含有的阴、阳离子总数是3 NA
D.标况下,11.2 L HF所含的分子数目为0.5NA
难度: 中等查看答案及解析
-
反应A(g)+3B(g)=2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.45 mol·L-1·min-1 ②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1 ④v(D)=0.45 mol·L-1·s-1
下列有关反应速率的比较中正确的是
A.④>③=②>① B.④<③=②<① C.①>②>③>④ D.④>③>②>①
难度: 中等查看答案及解析
-
化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的特殊情况。下列反应中属于这种情况的是
①过量的锌与18mol/L的硫酸反应;②过量的氢气与少量氮气在催化剂存在下充分反应;③过量的MnO2与浓盐酸;④过量铜与浓硫酸;⑤过量稀硝酸与银反应;⑥过量稀硫酸与块状石灰石
A.②③④⑥ B.②③⑤ C.①④⑤ D.①②③④⑤⑥
难度: 中等查看答案及解析
-
在某稀溶液中含有0.1 molHNO3和x molH2SO4向其中加入9.6 g铜粉,充分反应后产生的气体在标准状况下的体积为2.24 L,则x值至少为
A、0.1 B、0.12 C、0.15 D、0.2
难度: 中等查看答案及解析
-
以色列科学家Daniel Shechtman因发现准晶体获得2011年诺贝尔化学奖。人们在自然界中也找到了组成为Al63Cu24Fe13的天然准晶体。将相同质量的此准晶体分别与足量的盐酸、烧碱和稀硝酸反应,产生气体的物质的量关系为
A.n(烧碱)<n(稀硝酸)<n(盐酸) B.n(烧碱)<n(盐酸)<n(稀硝酸)
C.n(稀硝酸)<n(烧碱)<n(盐酸) D.n(盐酸)<n(稀硝酸)<n(烧碱)
难度: 中等查看答案及解析
-
下列化学用语的理解正确的是
A.离子结构示意图
:可以表示35Cl-,也可以表示37Cl-
B.电子式
:可以表示羟基,也可以表示氢氧根离子
C.比例模型
:可以表示甲烷分子,也可以表示四氯化碳分子
D.聚丙烯的结构简式:
难度: 中等查看答案及解析
-
下列物质转化在给定条件下不能实现的是
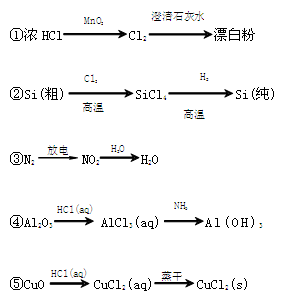
A.①③⑤ B.②③④ C.②③⑤ D.①④⑤
难度: 中等查看答案及解析
-
下列能达到实验目的的是
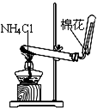
A.防倒吸 B.排水法收集NO2 C.实验室制氨气 D.除去杂质气体HCl
难度: 中等查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.向氯化铝溶液通入过量的氨气:Al3++4OH-=AlO2-+2H2O
B.MnO2与浓盐酸反应制Cl2: MnO2+4HCl
Mn2++2Cl-+Cl2↑+2H2O
C.FeCl3溶液用于蚀刻印刷电路:Cu+2Fe3+=Cu2++2Fe2+
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
某澄清透明溶液中只可能含有:
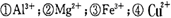
中的几种,向该溶液中逐滴加人NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是

A.②⑤⑦ B.②③⑤⑦ C.③⑤⑦ D.④⑤⑦
难度: 中等查看答案及解析
-
某同学为检验溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作。其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝。由该实验能得到的正确结论是
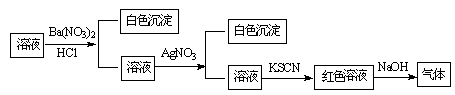
A.原溶液中一定含有SO42-离子 B.原溶液中一定含有NH4+离子
C.原溶液中一定含有Cl-离子 D.原溶液中一定含有Fe3+离子
难度: 中等查看答案及解析