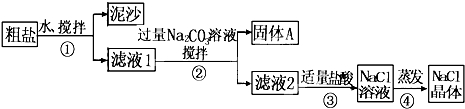
-
用饱和的FeCl3溶液制取Fe(OH)3胶体,正确的操作是( )
A.将FeCl3溶液滴人蒸馏水中
B.将FeCl3溶液滴人热水中,生成棕黄色液体
C.将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色液体
D.将FeCl3溶液滴人沸水中,并继续煮沸至生成红褐色沉淀难度: 中等查看答案及解析
-
现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如下表.据此,将甲和乙互相分离的最佳方法是( )
物质 分子式 熔点/℃ 沸点/℃ 密度/g•cm-3 水中
溶解性甲 C3H6O2 -98 57.5 0.93 可溶 乙 C4H8O2 -84 107 0.98 可溶
A.萃取法
B.升华法
C.蒸馏法
D.分液法难度: 中等查看答案及解析
-
下列化学方程式中,不能用离子方程式 Ba2++SO42-═BaSO4↓表示的是( )
A.Ba(NO3)2+H2SO4═BaSO4↓+2HNO3
B.BaCl2+Na2SO4═BaSO4↓+2NaCl
C.BaCO3+H2SO4═BaSO4↓+H2O+CO2↑
D.BaCl2+H2SO4═BaSO4↓+2HCl难度: 中等查看答案及解析
-
近年来,我国的一些沿江或沿海城市多次出现大雾天气,致使高速公路关闭,航班停飞.雾属于下列分散系中的( )
A.溶液
B.悬浊液
C.乳浊液
D.胶体难度: 中等查看答案及解析
-
完全沉淀等物质的量浓度的NaCl、MgCl2、AlCl3溶液中的Cl-,消耗等物质的量浓度的AgNO3溶液的体积比为3:2:1,则上述溶液的体积比为( )
A.1:1:1
B.3:2:1
C.9:3:1
D.6:3:2难度: 中等查看答案及解析
-
在19世纪,化学家对氧化锆的化学式有争议.经测定,锆的相对原子质量为91,其氯化物的相对分子质量是233.若氧化锆中锆的化合价与氯化物中的相同,试判断氧化锆的化学式为( )
A.ZrO2
B.Zr2O
C.Zr2O3
D.ZrO难度: 中等查看答案及解析
-
下列各组中的离子,能在溶液中大量共存的是( )
A.K+、Mg2+、NO3-、Cl-
B.Ba2+、Na+、CO32-、OH-
C.Mg2+、Ba2+、OH-、NO3-
D.H+、K+、CO32-、SO42-难度: 中等查看答案及解析
-
下列实验操作中错误的是( )
A.在由氢氧化铜分解制氧化铜时,要边加热边用玻璃棒搅拌
B.用药匙或者纸槽把粉末状药品送入试管的底部
C.如果没有试管夹,可以临时手持试管给固体或液体加热手
D.过滤时玻璃棒的末端应轻轻靠在三层的滤纸上难度: 中等查看答案及解析
-
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
对于相同物质的量的SO2和SO3,下列说法中正确的是( )
A.硫元素的质量比为5:4
B.分子数之比为1:1
C.原子总数之比为4:3
D.质量之比为1:1难度: 中等查看答案及解析
-
用NA表示阿伏德罗常数,下列叙述正确的是( )
A.标准状况下,22.4 L酒精中含有的分子数为 NA
B.常温常压下,10.6 g Na2CO3固体中含有Na+个数为0.2 NA
C.25℃,1.01×105Pa下,NA 个CO2分子占有的体积为22.4 L
D.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA难度: 中等查看答案及解析
-
磁悬浮的核心技术是利用超导体的反磁性.以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox.现欲合成 0.5mol 此高温超导物质,理论上需取Y2O3、BaCO3和CuO的物质的量(单位:mol)分别为( )
A.0.50、0.50、0.50
B.0.50、1.0、1.5
C.0.25、1.0、1.5
D.1.0、0.25、0.17难度: 中等查看答案及解析
-
等质量的①CH4、②H2、③HCl、④SO2,在标况下体积由大到小顺序是( )
A.②>①>③>④
B.④>③>①>②
C.③>②>④>①
D.①>④>②>③难度: 中等查看答案及解析
-
下列物质中导电能力最差的是( )
A.固体氯化钾
B.氯化钠溶液
C.熔融氢氧化钠
D.液态汞难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.将固体CuO加入稀H2SO4中:CuO+2H+=Cu2++H2O
B.氢氧化钡与硫酸反应:Ba2++H++SO42-+OH-=BaSO4↓+H2O
C.把金属铁放入稀硫酸中制取氢气:2Fe+6H+=2Fe3++3H2↑
D.石灰石与盐酸反应制取二氧化碳:CO32-+2H+=CO2↑+H2O难度: 中等查看答案及解析
-
物质X(
)和物质Y(
)的反应中,微粒之间的关系如图所示,对该反应的描述,下列反应方程式正确的是( )
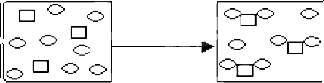
A.3X+8Y→X3Y8
B.X+2Y→XY2
C.3X+6Y→X3Y6
D.3X+8Y→3XY2+2Y难度: 中等查看答案及解析