-
下列物质的水溶液能导电,但属于非电解质的是( )
A. HCl B. Cl2 C. NaHCO3 D. CO2
难度: 简单查看答案及解析
-
分类法在化学学科发展中起到了非常重要的作用,下列分类标准合理的是( )
A. 根据是否含有氧元素,将物质分为氧化剂和还原剂
B. 根据是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
C. 根据水溶液是否能够导电,将物质分为电解质和非电解质
D. 根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
难度: 中等查看答案及解析
-
化学试剂不变质和实验方法科学是化学实验成功的保障.下列试剂保存方法或实验方法中,不正确的是( )
A. 实验室中金属钠通常保存在煤油里
B. 液溴易挥发,在存放液溴的试剂瓶中应加水封
C. 保存FeCl3溶液时,通常在溶液中加少量的单质铁
D. 浓硝酸通常保存在棕色试剂瓶中,置于阴凉处
难度: 中等查看答案及解析
-
铜粉放入稀硫酸溶液中,加热后无明显现象发生,当加入一种盐后,铜粉的质量减少,溶液呈蓝色,同时有气体逸出,该盐可以是
A. Fe2(SO4)3 B. KNO3 C. FeSO4 D. Na2CO3
难度: 中等查看答案及解析
-
下列与化学概念有关的说法正确的是( )
A. 化合反应均为氧化还原反应
B. 金属氧化物均为碱性氧化物
C. 烧碱、纯碱、熟石灰都是碱
D. BaSO4、NaOH、HNO3都是强电解质
难度: 中等查看答案及解析
-
下列各组离子中,能在溶液中大量共存的是( )
A. Na+、Cu2+、Cl﹣、OH﹣ B. H+、Ca2+、HCO3﹣、NO3﹣
C. Fe2+、H+、SO42﹣、NO3﹣ D. Na+、CO32﹣、OH﹣、K+
难度: 中等查看答案及解析
-
下列叙述正确是的( )
A. 人工固氮的过程一定涉及到氧化还原反应
B. 简单的金属阳离子只有氧化性,简单的非金属阴离子只有还原性
C. 1mol钠在足量氧气中燃烧生成Na2O2,失去2mol电子
D. 发生化学反应时,得电子越多的物质,氧化能力越强
难度: 中等查看答案及解析
-
下列转化必须加入氧化剂才能进行的是( )
A. HCO3﹣→CO2 B. MnO4﹣→Mn2+ C. Fe2+→Fe3+ D. Na2O2→O2
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. S在过量的O2中充分燃烧,可得SO3
B. 除去在Na2CO3固体中混有的NaHCO3的最好办法是通入过量的CO2
C. 鉴别NaHCO3溶液与Na2CO3溶液,可用澄清的石灰水
D. 等物质的量Na2CO3和NaHCO3与盐酸反应,消耗HCl的物质的量之比为2:1
难度: 中等查看答案及解析
-
为了除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤,②加过量NaOH溶液,③加适量盐酸,④加过量Na2CO3溶液,⑤加过量BaCl2溶液.正确的操作顺序是( )
A. ④②⑤③① B. ⑤②④①③ C. ②⑤④③① D. ④①②⑤③
难度: 中等查看答案及解析
-
NaNO2像食盐一样有咸味,有很强的毒性,误食亚硝酸钠(NaNO2)会使人中毒.已知亚硝酸钠能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O.下列说法正确的是( )
A. 该反应的氧化剂为HI
B. 反应产物中能使淀粉变蓝的物质有I2、NaI
C. 该反应中氧化剂与还原剂物质的量之比为1:1
D. 人误食亚硝酸钠中毒时,可以服用HI溶液解毒
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. Cl2、SO2均能使品红溶液褪色,说明二者均有氧化性
B. 常温下,铜片放入浓硫酸中,无明显变化,说明铜在冷的浓硫酸中发生钝化
C. Fe与稀HNO3、稀H2SO4反应均有气泡产生,说明Fe与两种酸均发生置换反应
D. 分别充满HCl、NH3的烧瓶倒置于水中后液面均迅速上升,说明二者均易溶于水
难度: 中等查看答案及解析
-
下列反应的离子方程正确的是( )
A. 钠与水反应:Na+2H2O=Na++2OH﹣+H2↑
B. Fe Cl3溶液中加入足量的氨水:Fe3++3OH﹣=Fe (OH)3↓
C. 钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+
D. 用小苏打治疗胃酸过多:HCO3﹣+H+=CO2↑+H2O
难度: 中等查看答案及解析
-
“PM2.5”是指大气中直径小于或等于2.5微米的颗粒物.它与空气中的SO2接触时,SO2会部分转化为SO3.则“PM2.5”的颗粒物在酸雨形成过程中主要的作用是下列的( )
A. 还原作用 B. 氧化作用 C. 催化作用 D. 抑制作用
难度: 简单查看答案及解析
-
合成新物质是研究化学的主要目的之一.意大利科学家最近合成了一种新型的氧分子O4.下列关于O4的说法中,正确的是( )
A. O4是一种新型的化合物
B. 1个O4分子由两个O2分子构成
C. 等质量的O4和O2含氧原子数目相同
D. O4和O2可通过氧化还原反应实现转化
难度: 简单查看答案及解析
-
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是( )
氧化物
环境问题
主要来源
A
CO2
酸雨
化石燃料的燃烧
B
CO
CO中毒
汽车尾气和化石燃料的不完全燃烧
C
NO2
温室效应
工厂废气的排放
D
SO2
光化学烟雾
汽车尾气的排放
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列装置所示的实验中,能达到实验目的是( )
A. 分离碘和酒精
 B. 除去Cl2中的HCl
B. 除去Cl2中的HCl 
C. 实验室制氨气
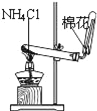 D. 排水法收集NO
D. 排水法收集NO
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下面叙述正确的是( )
A. 标准状况下,11.2L CCl4所含分子数为0.5NA
B. 1L 1mol/L的氯化钠溶液中,所含离子数为NA
C. 常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3NA
D. 1mol Cl2与足量的铁发生反应,转移的电子总数为3NA
难度: 中等查看答案及解析
-
根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
①I2+SO2+2H2O=H2SO4+2HI
②2FeCl2+Cl2=2FeCl3
③FeCl3+2HI=2FeCl2+2HCl+I2
A. I->Fe2+>Cl->SO2 B. Cl->Fe2+>SO2>I-
C. Fe2+>I->Cl->SO2 D. SO2>I->Fe2+>Cl-
难度: 中等查看答案及解析
-
下列实验“操作和现象”与“结论”对应关系正确的是( )
选项
实验操作及现象
实验结论
A
向某溶液中加入氯化钡溶液,有白色沉淀生成,再加盐酸酸化,沉淀不溶解
该溶液中一定含有SO42﹣
B
向某溶液中同时加入几滴KSCN溶液和少量新制的氯水,溶液变为红色
该溶液中一定含有Fe2+
C
向某溶液中加入稀盐酸,产生能使澄清石灰水变浑浊的无色气体
该溶液中一定含有CO32﹣
D
向某溶液加入NaOH并微热,产生能够使湿润的红色石蕊试纸变蓝的无色气体
该溶液中一定含有NH4+
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某同学设计下列实验装置进行卤素的性质实验.玻璃管内装有分别滴有不同溶液的棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )


A. A B. B C. C D. D
难度: 中等查看答案及解析
-
现有1.92g铜投入一定量的浓硝酸中,铜完全溶解,生成的气体颜色越来越浅,共收集到标准状况下的气体672mL,将盛有该气体的容器倒扣在水中,通入标准状况下一定体积的氧气,恰好使气体完全溶于水中,则通入氧气的体积是( )
A. 168mL B. 224mL C. 504mL D. 336mL
难度: 中等查看答案及解析
-
碳跟浓硫酸共热产生的混合气体X和铜跟浓硝酸反应产生的混合气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图),下列说法正确的是( )

A. 洗气瓶中产生的沉淀是BaCO3
B. 在Z导管出来的气体中无CO2
C. 洗气瓶中产生的沉淀是BaSO3
D. 在Z导管口有红棕色气体
难度: 中等查看答案及解析

