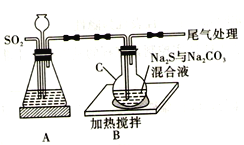
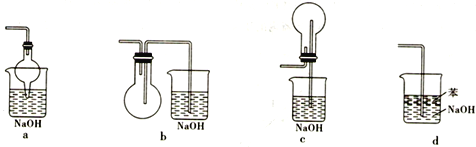
-
下列实验操作、现象和结论均正确的是
选项
实验操作
现象
结论
A
向包有Na2O2粉末的脱脂棉滴2滴水
脱脂棉燃烧
Na2O2与水反应放热
B
Fe(NO3)2样品中加入稀硫酸,再滴加KSCN溶液
溶液变为血红色
Fe(NO3)2样品已经变质
C
向FeCl3溶液中加入Mg(OH)2悬浊液,振荡
沉淀由白色变为红褐色
Fe(OH)3的溶度积小于Mg(OH)2
D
向蔗糖溶液中加入稀硫酸,加热几分钟后加入新制Cu(OH)2悬浊液,加热煮沸
无红色沉淀生成
蔗糖没有发生水解反应生成葡萄糖
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
前20号元素W、X、Y、Z原子序数依次递增,W原子最外层电子数是次外层的3倍,X的简单离子半径在同周期中最小。W、Z的质子数之和等于X、Y的质子数之和,X、Y、Z的最外层电子数之和等于W的核外电子数。下列说法错误的是
A. W与X的简单离子具有相同的电子层结构
B. 1mol Y的最高价氧化物含共价键数目为4NA
C. X、Z分别与W形成的化合物都具有相同类型的化学键
D. X、Y的单质均可以和Z的最高价氧化物对应的水化物溶液反应
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. S+2KNO3+3C= K2S+3CO2↑+N2↑每生成0.5mol N2,反应中转移电子数为6NA
B. a g C2H4和C3H6混合气体含有的原子数目为a NA/14
C. lL 0.2mol/L NaHCO3溶液中含HCO3- 和CO32-的离子数之和为0.2NA
D. 1mol·L-1的NaClO溶液中含有ClO-的数目小于NA
难度: 困难查看答案及解析
-
化学与生产、生活密切相关,下列说法不正确的是
A. 酸雨样品露天放置一段时间,酸性增强,是因为发生了氧化还原反应
B. 将草木灰与NH4H2PO4混合施用,可更好为植物全面提供N、P、K 三种营养元素
C. 纳米铁粉可将地下水中的NO3-转化为N2,是因为纳米铁粉具有还原性
D. 生活中常用可溶性铝盐净水,可加速水中悬浮物沉降
难度: 中等查看答案及解析
-
化合物a、b的结构简式如图所示,下列说法正确的是
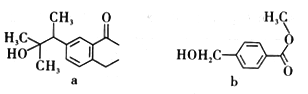
A. 化合物b不能使酸性高锰酸钾溶液褪色 B. a的消去产物中最多有15个碳原子共面
C. a、b均能发生还原反应、取代反应、消去反应 D. b分子发生加成反应最多消耗4mol H2
难度: 困难查看答案及解析
-
用甲醇燃料电池作电源,用铁作电极电解含Cr2O72-的酸性废水,利用生成的Fe2+可将Cr2O72-转化成Cr(OH)3沉淀而除去,装置如图。下列说法正确的是
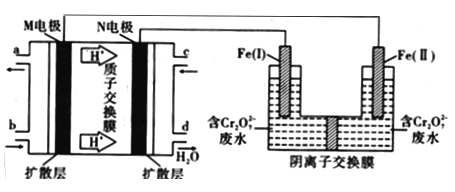
A. 由b口加入物质为O2
B. 燃料电池负极的电极反应式为CH3OH+8OH--6e-= CO32-+6H2O
C. 电解过程中,Fe(I)质量减少,Fe(Ⅱ)上有气体产生
D. 电路中每转移6mol电子,最多有1mol Cr2O72-被还原
难度: 困难查看答案及解析
-
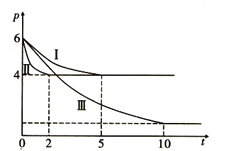
常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是
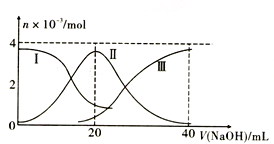
A. 当V( NaOH )= 20mL时,pH<7
B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)
难度: 困难查看答案及解析
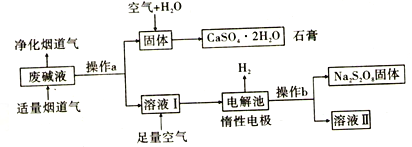
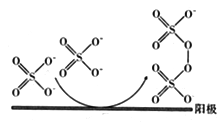
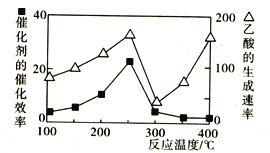
 。
。