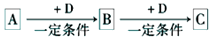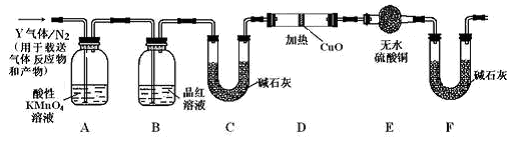-
化学与生产、生活密切相关。下列叙述中,不正确的是
①制作计算机芯片的材料是Si晶体,漂白液的有效成分是NaClO
②二氧化碳和氮气均是造成温室效应的气体
③食醋可去除水垢,NH4Cl溶液可去除铁锈
④SO2和NO2都能使雨水的pH < 5.6,造成酸雨
⑤硅胶可用作食品干燥剂
⑥向FeCl3溶液中不断加入NaOH溶液制备Fe(OH)3胶体
⑦用铜粉和硫粉混合加热制备CuS
⑧向铝盐溶液中不断滴入烧碱溶液制备Al(OH)3
A.②③⑦ B.②⑥⑦⑧ C.②③⑦⑧ D.①②③⑥⑧
难度: 简单查看答案及解析
-
下列说法不正确的是
① CO2分子的比例模型示意图:
②-OH与
组成元素相同,含有的电子数也相同
③HCN分子的结构式:H-C≡N;
④NaHCO3在水中的电离方程式:NaHCO3
Na++H++CO32-;
⑤Na2O的水溶液能导电,这不能说明Na2O是电解质;
⑥铝既能与盐酸反应又能与NaOH溶液反应,故铝是两性元素;
⑦风化、干馏、裂化都是化学变化
A.①②⑤ B.③④⑦ C.①④⑥ D.④⑤⑥
难度: 简单查看答案及解析
-
下列制备和收集气体的实验装置合理的是

难度: 中等查看答案及解析
-
分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
A.H2O、HCOOH、Cu2(OH)2CO3均含有氧元素,都是氧化物
B.HClO、浓硫酸、HNO3均具有氧化性,都是氧化性酸
C.HF、CH3COOH、CH3CH2OH都易溶于水,都是电解质
D.NaF、MgO、AlCl3均由活泼金属和活泼非金属化合而成,都是离子化合物
难度: 中等查看答案及解析
-
下边实验与物质粒子大小无直接关系的是
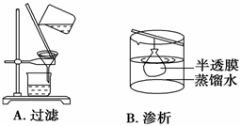
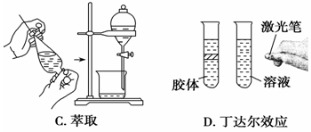
难度: 简单查看答案及解析
-
若NA表示阿伏加德罗常数的值,下列说法正确的是
A.16g CH4与18 g NH4+ 所含质子数相等
B.0.5mol FeCl3滴入沸水可制备胶体粒子0.5 NA
C.将分子总数为NA的NH3和HCl的混合气体置于标准状况下,其体积为约22.4L
D.7.8 g Na2O2中含有的离子总数目为0.3NA
难度: 困难查看答案及解析
-
下列溶液中的离子一定能大量共存的是
A.在加入铝粉能产生氢气的溶液中:NH4+、Fe2+、SO42-、NO3-
B.室温下由水电离出的氢离子浓度c(H+)=1×10-14mol/L的溶液中:Ba2+、NO3-、K+、ClO-
C.能使酚酞变红色的溶液中:Na+、K+、AlO2-、CO32-
D.含大量Fe3+的溶液中:NH4+、Na+、C1-、SCN-
难度: 困难查看答案及解析
-
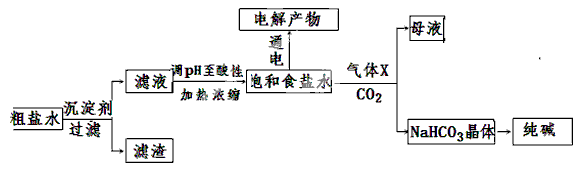
海水开发利用的部分过程如图所示。下列说法错误的是
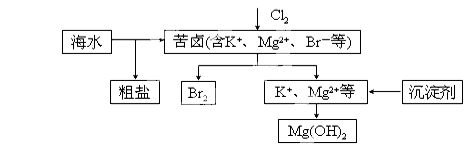
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
难度: 中等查看答案及解析
-
下列说法正确的是
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.做蒸馏实验时,在蒸馏烧瓶中应加入沸石,以防暴沸。如果在沸腾前发现忘记加沸石,应立即停止加热,冷却后补加
C.在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解,说明该未知溶液中存在 SO42-或SO32-
D.提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再冷却结晶、过滤、干燥的方法
难度: 中等查看答案及解析
-
下列叙述I和II均正确并且有因果关系的是
叙述I
叙述II
A
NaHCO3能与碱反应
食品工业用NaHCO3作焙制糕点的膨松剂
B
Al既可和酸反应又可和强碱反应
Al可制成铝箔包装物品
C
K2FeO4能与水作用生成Fe(OH)3胶体和O2
可K2FeO4用于净化自来水并杀菌消毒
D
HClO具有弱酸性
HClO可作漂白剂
难度: 中等查看答案及解析
-
下列有关试剂的保存方法正确的是
①NaOH固体保存在配有橡皮塞的细口瓶中;
②Na2CO3溶液通常保存在配有橡皮塞的细口瓶中;
③液溴通常用水封保存;
④锂保存在煤油中;
⑤浓硝酸通常保存在棕色细口瓶中
A.①③⑤ B.②③⑤ C.②④⑤ D.①③④
难度: 简单查看答案及解析
-
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、SCN-、Br-可以大量存在
B.和KI溶液反应的离子方程式: Fe3++2I-=Fe2++I2
C.和Ba(OH)2溶液反应离子方程式:Fe3++ SO42-+Ba2++3OH-=Fe(OH)3↓+BaSO4↓
D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2g Fe
难度: 中等查看答案及解析
-
下表各组物质中,物质之间不可能实现如图
所示转化的是
选项
X
Y
Z
M
A
Fe(s)
FeCl2
FeCl3
Cl2
B
NaOH(aq)
Na2CO3
NaHCO3
CO2
C
NH3(g)
NO
NO2
O2
D
S(s)
SO2
SO3
O2
难度: 中等查看答案及解析
-
研究发现CuSO4和FeS2在一定条件下可发生如下反应: 14CuSO4+5FeS2+12H2O =7Cu2S +5FeSO4 +12H2SO4;下列说法正确的是
A.FeS2中的硫元素全部被氧化
B.5 mol FeS2发生反应,有10 mol电子转移
C.产物中SO42-有一部分是氧化产物
D.FeS2只用作还原剂
难度: 中等查看答案及解析
-
下列关于物质或离子检验的叙述正确的是
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32—+2H+=SO2↑+H2O
B.CuSO4溶液与过量浓氨水反应的离子方程式:Cu2++2NH3-H2O=Cu(OH)2↓+2NH4+
C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:
Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓ + AlO2-↓ +2 H2O
D.向CuSO4溶液中加入Na2O2:2 Na2O2+2Cu2++2H2O=4Na++2Cu(OH)2↓+O2↑
难度: 困难查看答案及解析
-
下述实验操作与预期实验目的或所得实验结论不一致的是
编号
实验操作
实验目的或结论
A
将SO2气体通入紫色石蕊试液中,观察溶液是否褪色
证明SO2有漂白性
B
向试管中加入等体积的0.005mol/L的FeCl3溶液和0.01mol/L的KSCN溶液,再滴加几滴饱和FeCl3溶液,观察颜色变化
探究增大反应物浓度时平衡移动的方向
C
将装有NO2和N2O4气体的连通球,一个置于冰水中,一个置于热水中,观察颜色变化
探究温度对化学平衡的影响
D
将CO2通入Na2SiO3水溶液观察是否有沉淀产生
探究碳和硅两元素非金属性强弱
难度: 中等查看答案及解析
-
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是
A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.滴加KI溶液时,KI被氧化,CuI是氧化产物
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
难度: 困难查看答案及解析
-
向足量的下列物质分别与一定量氯水反应后所得的溶液中滴入KSCN溶液,不一定显血红色的是
A.氧化铁 B.铜铁合金 C.Fe(OH)3 D.FeCl2
难度: 中等查看答案及解析
-
CuSO4是一种重要的化工原料,其有关制备途径及性质如下图所示。下列说法不正确的是

A.相对于途径①,途径②更好地体现了绿色化学思想
B.Y可以是葡萄糖溶液
C.CuSO4在1100℃分解所得混合气体X一定有O2
D.途径①所用混酸中H2SO4与HNO3物质的量之比最好为3:1
难度: 中等查看答案及解析
-
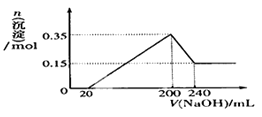
某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则下列说法正确的是
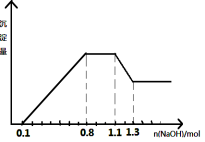
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32-和NO3-,一定含有SO42-
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+)∶c (Al3+)∶c(Mg2+)=1∶1∶1
难度: 困难查看答案及解析
-
物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是
物质及其杂质
检验
除杂
A
Cl2(HCl)
湿润的淀粉KI试纸
饱和食盐水
B
NO(NO2)
观察颜色或湿润的淀粉KI试纸
水
C
CO2(HCl)
AgNO3溶液(含稀硝酸)
饱和Na2CO3溶液
D
NaHCO3溶液(Na2CO3)
Ca(OH)2溶液
过量CO2
难度: 中等查看答案及解析
-
类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中,错误的是
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
④密度为1.1 g·cm-3与密度为1.2 g·cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g·cm-3与1.2 g·cm-3之间,Na-K合金的熔点应介于Na和K熔点之间
A.①② B.①④ C.①②③④ D.①②④
难度: 困难查看答案及解析
-
镁铁混合物13.8g溶解在足量某浓度的稀硝酸中,完全反应,其还原产物只有一氧化氮(0.3mol),则向反应后的溶液中加入足量的NaOH溶液,可生成的沉淀质量为
A.26g B.29.1g C.29.5g D.24g
难度: 困难查看答案及解析
-
1.76克铜镁合金完全溶解于50mL、密度为1.40g/cm3、质量分数为63%的浓硝酸中,得到NO2 气体1792mL (标准状况),向反应后的溶液中加入适量的1.0mol/LNaOH溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
B.加入NaOH溶液的体积是50mL
C.浓硝酸在与合金反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08mol
D.得到的金属氢氧化物的沉淀为3.12克
难度: 困难查看答案及解析