-
下列分子叫手性分子的是
A.CH3CH2OH B.HOOC-CHOH-CHCl-COOH
C.CFCl3 D.CH2OH-CHOH-CH2OH
难度: 简单查看答案及解析
-
下列说法正确的是
A.钾(K)原子基态的原子结构示意图为
B.H2O电子式为
C.O的原子基态电子的轨道表示式为
D.Ca2+离子基态电子排布式为1s22s22p63s23p64s2
难度: 中等查看答案及解析
-
下列各组原子中,彼此的化学性质一定相似的是
A.P原子:1s2 Q原子:2s2
B.P原子:M电子层上有2个电子 Q原子:N电子层上有2个电子
C.P原子:2p能级上有1个未成对电子 Q原子:3p能级上有1个未成对电子
D.P原子:最外电子层L层上只有一个空轨道 Q原子:3P能级上只有一个空轨道
难度: 中等查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是
A.CO2、H2S B.C2H4、CH4 C.C60、C2H4 D.NH3、HCl
难度: 中等查看答案及解析
-
下列事实与氢键有关的是
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随着相对分子质量的增加而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
难度: 中等查看答案及解析
-
下列粒子属于等电子体的是
A.CH4和NH4+ B.NO和O2 C.NH2-和O3 D.HCl和H2O
难度: 中等查看答案及解析
-
下列有关物质性质的比较顺序中,不正确的是
A.热稳定性:HF>HCl>HBr>HI
B.微粒半径:K+>Na+>Mg2+>Al3+
C.酸性:HClO4>H2SO4>H3PO4>H2SiO3
D.熔点:Li<Na<K<Rb
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
A.第一电离能:④>③>②>① B.原子半径:④>③>②>①
C.电负性:④>③>②>① D.最高正化合价:④>③=②>①
难度: 中等查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2…表示,单位为kJ•mol-1).下列关于元素R的判断中一定正确的是( )
I1
I2
I3
I4
…
R
740
1 500
7 700
10 500
①R的最高正价为+3价
②R元素位于元素周期表中第ⅡA族
③R元素第一电离能大于同周期相邻元素
④R元素基态原子的电子排布式为1s22s2
A.①② B.②③ C.③④ D.①④
难度: 中等查看答案及解析
-
下列物质的分子中既有δ键,又有π键的是
①HCl ②H2O ③N2 ④H2O2 ⑤C2H4 ⑥C2H2.
A.①②③ B.③④⑤⑥ C.①③⑥ D.③⑤⑥
难度: 中等查看答案及解析
-
下列说法中正确的是
A.HCHO分子中既含δ键又含π键
B.CO2分子中的化学键为非极性键
C.NH3分子中N原子的杂化轨道类型是sp2
D.沸点:PH3>NH3>H2O
难度: 简单查看答案及解析
-
PH3是一种无色剧毒气体,其分子结构和NH3相似,但P—H键键能比N—H键键能低。下列判断错误的是
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3沸点低于NH3沸点,因为P-H键键能低
D.PH3分子稳定性低于NH3分子,因为N-H键键能高
难度: 中等查看答案及解析
-
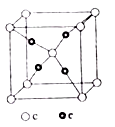
有下列离子晶体的空间结构示意图。图中●和化学式中M分别代表阳离子,图中○和化学式中N分别代表阴离子,则化学式为MN2的晶体结构为

难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4。下列说法正确的是
A.W、Y、Z的电负性大小顺序一定是Z>Y>W
B.W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C.Y、Z形成的分子空间构型可能是正四面体
D.WY2分子中δ键与π键的数目之比是2:1
难度: 中等查看答案及解析
-
用VSEPR模型预测下列分子或离子的立体结构,其中不正确的是
A.NH4+为正四面体形 B.CS2为直线形
C.HCN为折线形(V形) D.PCl3为三角锥形
难度: 中等查看答案及解析