-
下列过程中,没有发生化学变化的是( )
A. 工业上用氮气和氢气合成氨
B. 蔗糖中加入浓硫酸,蔗糖变黑,体积膨胀
C. 雷雨天气氮气转化为氮的氧化物
D. 液氨常用作制冷剂
难度: 简单查看答案及解析
-
下列各组气体,在通常情况下既能用浓硫酸又能用碱石灰干燥的有( )
A. SO2、O2、NH3
B. HCl、Cl2、CO2
C. O2、H2、CO
D. SO2、Cl2、O2
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. SO2能使品红溶液褪色,是因为SO2具有氧化性将品红氧化
B. 9g 重水(D2O)中含有5mol质子
C. 浓硝酸中的HNO3见光会分解,故有时在实验室看到的浓硝酸呈黄色
D. 同位素的物理性质和化学性质完全相同
难度: 简单查看答案及解析
-
在同一条件下,体积相同的三个烧瓶中分别盛有NH3、HC1、NO2气体,并分别倒立在水槽中,充分反应后,烧瓶内三种溶液的物质的量浓度之比为(设烧瓶中的溶液未扩散到水槽里)( )
A. 3:3:2 B. 2:2:3 C. 1:1:1 D. 2:2:1
难度: 中等查看答案及解析
-
下列说法中,正确的是( )
A. 构成原子核的微粒中都含有中子
B. 任何原子或离子的组成中都含有质子
C. 质子数相同的微粒一定属于同一种元素
D. 某元素原子最外层有2个电子,则它一定是ⅡA元素
难度: 简单查看答案及解析
-
据科学家预测,月球的土壤中吸附着数百万吨的
He,每百吨
He核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氦元素主要以
He的形式存在。下列说法正确的是( )。
A.
He原子核内含有4个质子
B.
He和
He互为同位素
C.
He原子核内含有3个中子
D.
He的最外层电子数为2,所以
He具有较强的金属性
难度: 中等查看答案及解析
-
绘制了第一张元素周期表的科学家是( )
A. 戴维 B. 侯德榜 C. 门捷列夫 D. 道尔顿
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 元素周期表有16个纵行,也就是16个族
B. 元素周期表中元素排序的依据是原子的核电荷数
C. 原子的最外层电子数相同的元素,一定属于同一族
D. 电子层数相同的粒子,对应元素一定属于同一周期
难度: 中等查看答案及解析
-
钾(K)与Na在性质上具有很大的相似性,但K比Na的活泼性强,下面是根据Na的性质对K的性质的预测,其中正确的是( )
A. 因为K的活泼性强,所以少量钾不能保存在煤油中
B. K可以在空气中燃烧,火焰呈黄色,且产物是K2O
C. K与水能够反应,但不如Na与水的反应剧烈,但产物都有氢气
D. K可以与水剧烈反应,生成氢气
难度: 简单查看答案及解析
-
下列叙述中错误的是
A. 酸性:HClO4 > H2SO4 > H3PO4 B. 还原性:Na > Mg > Al
C. 稳定性:HF > HCl > HBr D. 原子半径:Cl > S > O
难度: 简单查看答案及解析
-
主族元素在周期表的位置,取决于元素原子的( )
A. 中子数
B. 相对原子质量
C. 电子层数和最外层电子数
D. 次外层电子数
难度: 简单查看答案及解析
-
2011年3月30日,在我国许多地区空气中监测到来自日本核事故释放出的极微量人工放射性核素
,该原子的原子核内中子数与核外电子数之差为( )
A. 131 B. 78 C. 53 D. 25
难度: 简单查看答案及解析
-
下列关于碱金属某些性质的排列中,不正确的是( )
A. 原子半径:Li<Na<K
B. 熔点:Li>Na>K
C. 密度:Li<Na<K
D. 沸点:Li>Na>K
难度: 简单查看答案及解析
-
按氟、氯、溴、碘顺序,下列说法不正确的是( )
A. 它们的单质的熔沸点逐渐升高
B. 原子半径逐渐增大,单质氧化性逐渐增强
C. 单质的颜色逐渐加深
D. 它们气态氢化物的稳定性逐渐减弱
难度: 简单查看答案及解析
-
某阴离子Rn- 的核外共有x个电子,核内有a个中子,则R的质量数为( )
A. a+x-n B. a+x+n C. a-x-n D. a-x+n
难度: 简单查看答案及解析
-
下列叙述中不正确的是( )
A. 元素在周期表中的位置,反映了元素的原子结构和元素的性质
B. 硫酸的酸性比次氯酸的酸性强,所以硫的非金属性比氯强
C. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
D. 人们在过渡元素中寻找催化剂和耐高温、耐腐蚀的合金材料
难度: 简单查看答案及解析
-
已知A2+ 离子共含有x个中子,A元素的质量数为m,则n克A2+ 离子共含有电子的物质的量为( )
A.
mol B.
mol C.
mol D.
mol
难度: 简单查看答案及解析
-
下列固体或分子中,含有化学键类型有差异的一组是( )
A. H2O、CO2 B. MgF2、H2O
C. KOH、NH4Cl D. NaCl、KCl
难度: 简单查看答案及解析
-
已知主族元素X和Y的原子序数分别为a和b, 且原子半径为X>Y, 则下列说法中正确的是( )
A. a 一定大于b
B. a 一定小于b
C. 若X和Y在同一周期, a一定小于b
D. 若X和Y不在同一周期, 则a一定小于b
难度: 中等查看答案及解析
-
自然界中氯化钠是由
与
和
所构成的。已知氯元素的相对原子质量是35.5,则11.7g氯化钠中,含
的质量为( )
A. 1.75g B. 1.85g C. 5.25g D. 5.55g
难度: 中等查看答案及解析
-
短周期元素X和Y可以形成XY4型化合物,若X的原子序数为a,Y的原子序数为b,则a和b的相互关系不可能是( )
A. a-13 = b
B. a +8 = b
C. b-11 = a
D. b+5 = a
难度: 中等查看答案及解析
-
下列各表为元素周期表中的一部分,表中数字为原子序数,其中M的原子序数为36的是( )
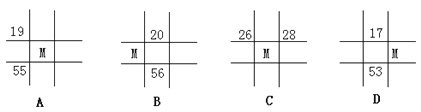
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
短周期元素X和Y中,X原子的最外层电子数比内层电子总数少4个电子,Y元素在X元素的前一周期,Y2-离子和Ne原子的电子层结构相同,关于X和Y形成的化合物Z的说法正确的是( )
A. Z可能既具有还原性又具有氧化性
B. Z对应的水化物难溶于水
C. Z的分子式一定是XY2
D. Z中含有离子键
难度: 简单查看答案及解析
-
下列过程中,共价键被破坏的是( )
A. 碘升华 B. 溴蒸气被木炭吸附 C. NaCl溶于水 D. HCl气体溶于水
难度: 中等查看答案及解析
-
有关过氧化氢的叙述正确的是( )
A. 过氧化氢是离子化合物
B. 过氧化氢分子只含有极性键
C. 过氧化氢分子只含有非极性键
D. 过氧化氢分子既含有非极性键又含有极性键
难度: 简单查看答案及解析