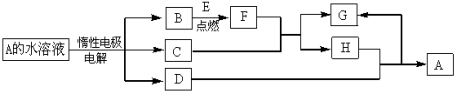
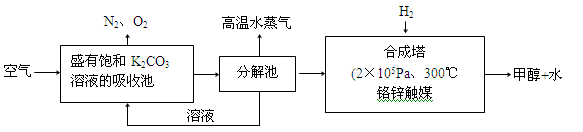
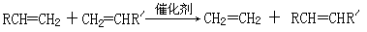-
下列说法正确的是
A.电解法精炼铜,当阴极质量增加32 g时,一定有6.02×1023个电子转移
B.含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022
C.28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子
D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022
难度: 中等查看答案及解析
-
已知某有机物X的结构简式如图所示,下列有关叙述不正确的是

A.X的化学式为C10H10O6
B.X在一定条件下能与FeCl3溶液发生显色反应
C.1 mol X分别与足量的Na、NaOH溶液、NaHCO3溶液反应,消耗这三种物质的物质的量分别为3 mol、4 mol、1 mol
D.X在一定条件下能发生消去反应和酯化反应
难度: 中等查看答案及解析
-
由一种阳离子和两种酸根离子组成的盐称混盐。下列关于混盐Na4S2O3的有关判断,不正确的是
A.该混盐水溶液呈碱性
B.该混盐与H2SO4反应有气体生成
C.该混盐溶液加入BaCl2可以生成白色沉淀
D.该混盐在酸性条件下可生成S,每产生32g S转移2NA个电子
难度: 中等查看答案及解析
-
A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中AC和BD的盐溶液的pH=7,BC盐溶液pH>7,则下列说法正确的是:
A、AD盐溶液pH>7
B、酸的电离程度一定是HD<HC
C、碱的电离程度一定是AOH>BOH
D、在AC盐溶液中c(A+)+ c(AOH)= c(C-)+ c(HC)
难度: 中等查看答案及解析
-
类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,正确的是
A.IVA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则VA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
B.第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
C.Fe3O4可以写成FeO·Fe2O3;Pb3O4也可以写成PbO·Pb2O3
D.NaHSO4与NaHSO3溶于水显酸性,则所有酸式盐溶于水显酸性
难度: 中等查看答案及解析
-
下列有关计算的分析正确的是
A.某溶液100mL,其中含硫酸0.03mol,硝酸0.04mol,若在该溶液中投入1.92 g铜粉微热,反应后放出一氧化氮气体约为0.015mol
B.室温时,在容积为a mL的试管中充满NO2气体,然后倒置在水中到管内水面不再上升时为止;再通入b mL O2,则管内液面又继续上升,测得试管内最后剩余气体为c mL,且该气体不能支持燃烧.则a、b的关系是a=4b+c
C.已知某温度Ksp(Ag2S)=6×10-50,Ksp(AgCl)=2×10-6,则2AgCl(s)+S2-(aq)
Ag2S(s)+2Cl-(aq)的平衡常数约为6.7×10-37
D.在25 ℃下,将2a mol·L-1的氨水与0.02 mol·L-1的盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),则用含a的代数式表示NH3·H2O的电离常数
难度: 困难查看答案及解析
-
X、Y、Z、M、W为五种短周期元素,X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状态下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径:W>Z>Y>X>M
B.将XZ2通入W单质与水反应后的溶液中,生成的盐一定只有一种
C.由X、Y、Z、M四种元素共同形成的化合物中一定有共价键可能有离子键
D.CaX2、CaM2和CaZ2等3种化合物中,阳离子与阴离子个数比为1∶2
难度: 中等查看答案及解析