-
下列电离方程式中,正确的是( )
A.Ba(OH)2=Ba2++(OH)-
B.FeCl3=Fe2++3Cl-
C.H2SO4=H2++SO42-
D.Al2(SO4)3=2Al3++3SO42-难度: 中等查看答案及解析
-
实验室里取用金属钠时,用到的仪器用品是( )
①试管夹 ②镊子 ③小刀 ④滤纸 ⑤试管 ⑥玻璃棒 ⑦药匙 ⑧玻璃片.
A.①③⑤⑦
B.②④⑥⑧
C.③④⑤⑧
D.②③④⑧难度: 中等查看答案及解析
-
分类法在化学学科的发展中起到了非常重要的作用,下列分类标准合理的是( )
A.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
B.根据反应中是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应
C.根据水溶液是否能够导电,将物质分为电解质和非电解质
D.根据是否含氧元素,将物质分为氧化剂和还原剂难度: 中等查看答案及解析
-
下列有关0.1mol/L的Na2CO3溶液的说法正确的是( )
A.1 L水中溶解了0.1 mol Na2CO3
B.1 L溶液中含有10.6 g Na2CO3
C.将10.6 g Na2CO3溶于1 L水配成的溶液
D.1 L溶液中含有0.2 mol Na+难度: 中等查看答案及解析
-
常温下,在溶液中可发生以下反应:①2Fe2++Br2=2Fe3++2Br- ②2Br-+Cl2=Br2+2Cl- ③2Fe3++2I-=2Fe2++I2.由此判断下列说法错误的是( )
A.铁元素在反应①中被还原,在③中被氧化
B.反应②中当有1 mol Cl2被还原时,有2 mol Br-被氧化
C.氧化性强弱顺序为:Cl2>I2>Br2>Fe3+
D.还原性强弱顺序为:I->Fe2+>Br->Cl-难度: 中等查看答案及解析
-
下列物质中,不属于电解质的是( )
A.NaOH
B.H2SO4
C.蔗糖
D.NaCl难度: 中等查看答案及解析
-
需加入氧化剂才能发生的变化是( )
A.CO32-→CO2
B.Cl-→Cl2
C.MnO4-→Mn2+
D.Fe3+→Fe2+难度: 中等查看答案及解析
-
下列四组物质中,前者属纯净物,后者属于混合物的一组是( )
A.天然气、空气
B.氯化钠、食醋
C.矿泉水、白酒
D.自来水、大理石难度: 中等查看答案及解析
-
标准状况下,等体积的NH3和CH4两种气体,下列有关说法错误的是( )
A.所含分子数目相同
B.所含氢原子物质的量之比为3:4
C.质量之比为16:17
D.密度之比为17:16难度: 中等查看答案及解析
-
不能用2H++CO32-═CO2↑+H2O表示的反应是( )
A.醋酸溶液与碳酸钠溶液反应
B.稀硝酸与碳酸钠溶液反应
C.稀硫酸与碳酸钾溶液反应
D.硫酸氢钠溶液与碳酸钾溶液反应难度: 中等查看答案及解析
-
下列反应中属于氧化还原反应,但水既不作氧化剂又不作还原剂的是( )
A.H2O+CaO=Ca(OH)2
B.2H2O+2F2=4HF+O2
C.2H2OO2↑+2H2↑
D.3NO2+H2O=2HNO3+NO难度: 中等查看答案及解析
-
实验是化学研究的基础,关于下列各实验装置的叙述中,错误的是( )
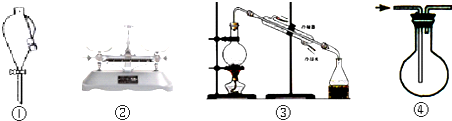
A.装置①可用于分离煤油和水
B.装置②可用于准确称取8.55 g氯化钠固体
C.装置③可用于从海水中得到淡水
D.装置④可用于排空气收集CO2难度: 中等查看答案及解析
-
在无色透明的强酸性溶液中,能大量共存的离子组是( )
A.Na+、Mg2+、NO3-、SO42-
B.K+、Na+、NO3-、HCO3-
C.K+、MnO4-、Na+、Cl-
D.Ag+、Na+、Cl-、OH-难度: 中等查看答案及解析
-
亚运会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾.撞击时发生反应的化学方程式为:5KClO3+6P=3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应中Cl的化合价由+5价变为-1价
B.P2O5是P被还原后所得的产物
C.该反应氧化剂与还原剂物质的量之比为5:6
D.上述反应中消耗3 mol P时,转移电子的物质的量为15 mol难度: 中等查看答案及解析
-
200mL的某NaOH溶液,其中含有4g溶质.用此溶液配制0.2mol/L的NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A.1:6
B.1:4
C.2:1
D.2:3难度: 中等查看答案及解析
-
关于钠的叙述正确的是( )
A.钠元素在自然界中都是以化合态存在
B.钠着火时可以用湿布盖灭
C.实验室少量的钠应保存在煤油或石蜡油中
D.钠可以从硫酸铜稀溶液中置换出铜单质难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.氯化钙溶液与碳酸钠溶液反应:Ca2++CO32-=CaCO3↓
B.氢氧化钡溶液与硫酸铜溶液反应:Ba2++SO42-=BaSO4↓
C.铁与稀硫酸反应:2Fe+6H+=3H2↑+2Fe3+
D.氢氧化镁与稀盐酸反应:Mg(OH)2+2 H+=Mg2++2H2O难度: 中等查看答案及解析
-
将V L(标准状况)氯化氢气体溶于0.2L水中,所得盐酸溶液的密度是a g/cm3,则所得盐酸溶液的物质的量浓度(mol/L)为
( )
A.
B.
C.
D.难度: 中等查看答案及解析