-
“天宫一号”的燃料是氢化锂三兄弟:LiH、LiD、LiT,其中Li的质量数为7。对这三种物质的说法中正确的是( )
A.质子数之比为1︰2︰3 B.中子数之比为1︰1︰1
C.摩尔质量之比为8︰9︰10 D.化学性质不相同
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,11.2 L乙醇所含的羟基数为0.5NA
B.常温下,1L 0.1 mol·L-1的Na2CO3溶液中含有的离子总数为0.3NA
C.常温常压下,5.6g乙烯和环丙烷的混合气体中含有的碳原子数为0.4NA
D.电解硫酸铜溶液时,阳极每生成标准状况下3.36L气体,电路中转移电子数为0.3NA
难度: 简单查看答案及解析
-
某温度下,反应2A(g)
B(g)+C(g)的平衡常数为1,在容积为2L的密闭容器中加入A(g)。20s时测得各组分的物质的量如下表:下列说法正确的是( )
物质
A(g)
B(g)
C(g)
物质的量/mol
1.2
0.6
0.6
A.反应前20s的平均速率为v(A)=0.6mol·L-1·S-1
B.20s时,正反应速率等于逆反应速率
C.达平衡时,A(g)的转化率为100%
D.若升高温度,平衡常数将变为0.5,则反应的△H<0
难度: 简单查看答案及解析
-
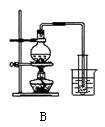
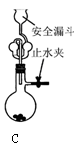
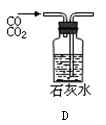
用下列实验装置进行相应实验,能达到实验目的的是( )
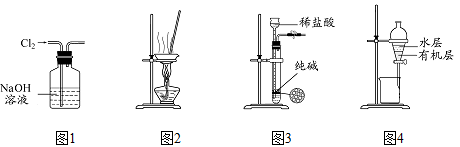
A.用图1 所示装置除去Cl2中含有的少量HCl
B.用图2 所示装置蒸干NH4HCO3饱和溶液制备NH4HCO3晶体
C.用图3 所示装置制取少量纯净的CO2气体
D.用图4 所示装置分离CCl4萃取碘水后已分层的有机层和水层
难度: 中等查看答案及解析
-
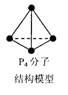
设nA为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温常压下,16g14CH4所含中子数目为8nA
B.标准状况下,22.4 LCCl4所含分子数目为nA
C.1 L 0.5 mol·L-1的CH3COONa溶液中所含的CH3COO-离子数目为0.5n
D.6.2g白磷(分子式为P4,分子结构如右图所示)所含P-P键数目为0. 3nA
难度: 困难查看答案及解析
-
已知溶液中:氧化性IO3—>I2>SO32-。向含3 mol NaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如右图所示,下列说法正确的是( )
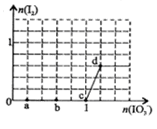
A.a点反应的还原剂是NaHSO3,被氧化的元素是碘元素
B.b点反应的离子方程式是:3HSO3-+IO3-+3OH-=3SO42-+I-+3H2O
C.c点到d点的反应中共转移0.6mol电子
D.往200mL 1 mol/L的KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式是:5HSO3-+ 2IO3- =I2+5SO42-+3H++H2O
难度: 困难查看答案及解析
-
用12moL·L-1浓盐酸配制250mi-0.1 mol.L-1的盐酸溶液时,下列实验操作会使配得的溶液浓度偏大的是( )
A. 用量筒量取浓盐酸时俯视读数
B. 最后定容时仰视读数
C. 将浓盐酸倒入烧杯后,用水洗涤量筒2—3次,并将洗涤液一并倒入容量瓶中
D. 定容后把容量瓶倒置摇匀,发现液面低于刻度,再加水至刻度线
难度: 简单查看答案及解析
-
下列能达到实验目的的是( )
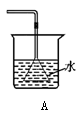
A.吸收HCl防倒吸 B.制取少量蒸馏水
C.CaCO3和稀硫酸制取CO2 D.除去杂质气体CO2
难度: 中等查看答案及解析
-
下列根据实验操作和现象所得出的结论正确的是( )
选项
实验操作
实验现象
结论
A
用铂丝蘸取少量某无色溶液进行焰色反应
火焰呈黄色
该溶液一定是钠盐溶液
B[XK]
向2mL NaCl和NaI(浓度均为0.1 mol·L-1 )混合溶液中滴入2滴0.1 mol·L-1 AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
向某溶液中加入盐酸酸化的Ba(NO3)2溶液
出现白色沉淀
该溶液一定有SO42-或Ag+
D
向淀粉水解液中加入新制Cu(OH)2,煮沸
没有生成砖红色沉淀
淀粉未水解
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是( )
A.22.4 L O2的质量约为32g
B.17g NH3所含原子数为4NA,所含电子数为10NA
C.标准状况下,22.4LH2O所含水分子为NA个
D.0.5 mol/L Fe2(SO4)3 溶液中,SO42-的数目为1.5 NA
难度: 中等查看答案及解析
-
下列有关氯化钠的实验中,选用的实验用品都能用到的是( )
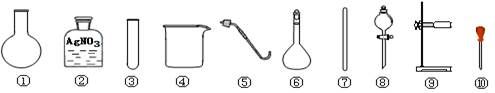
A. 除去粗盐中的不溶性杂质,选用④⑦⑧⑨
B. 检验A的滤液中是否含SO42-,选用②③⑩
C. 利用提纯后的NaCl固体配制0.1mol/L的溶液,选用④⑥⑦⑩
D. 用NaCl固体与浓H2SO4共热制备HCl气体,选用①⑤⑧⑨
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol Na与 O2完全反应生成Na2O或Na2O2均失去NA个电子
B.1mol Na2O2与足量CO2反应时,转移2NA个电子
C.1mol·L-1的NaOH溶液中含Na+数目为NA
D.23gNa+中含有的电子数为NA
难度: 简单查看答案及解析
-
下列实验操作中错误的是( )
A. 在由氢氧化铜分解制氧化铜时,要边加热边用玻璃棒搅拌
B. 用药匙或者纸槽把粉末状药品送入试管的底部
C. 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
D. 如果没有试管夹,可以临时手持试管给固体或液体加热
难度: 简单查看答案及解析
-
下列溶液中的氯离子数目与50 mL 1 mol/L的AlCl3溶液中氯离子数目相等的是( )
A.75 mL 2 mol/L的CaCl2 B.150 mL 1 mol/L的NaCl
C.150 mL 3 mol/L的KCl D.100 mL 2 mol/L的NH4Cl
难度: 简单查看答案及解析
-
设NA表示的值,下列叙述正确的是( )
A.标准状况下,2. 24LCH4含有的H原子数为0.1NA
B.常温常压下,NA个CO2分子占有的体积为22.4L
C.1 mol·L-1 A1Cl3溶液中含有的Cl-数目为3NA
D.2.4g金属镁变为镁离子时失去的电子数为0.2 NA
难度: 简单查看答案及解析
-
下列实验操作正确的是( )
A. 把试剂瓶中的Na2CO3溶液倒入试管中,发现取量过多,为了不浪费,又把多余的试剂倒入原试剂瓶中
B. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
C. 先在天平两个托盘上各放一张相同质量的纸,再把氢氧化钠固体放在纸上称
D. 萃取碘水中的碘时,可选择苯或酒精作萃取剂
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数,下列说法正确的是( )
A.23g金属钠变为钠离子时得到的电子数为NA
B.标准状况下,18g水所含的电子数目为10NA
C.标准状况下,11.2L氢气在足量的氧气中完全燃烧所得产物的分子数为NA
D.标准状况下,2.24 LN2和O2的混合气体所含原子数为0.2NA
难度: 简单查看答案及解析
-
在标准状况下,mgA气体与ngB气体分子数相等,下列说法不正确的是( )
A.标准状况下,同体积的气体A和气体B的质量比m∶n
B.25℃时,1Kg气体A与1Kg气体B的分子数之比为n∶m
C.同温同压下,气体A与气体B的密度之比为n∶m
D.标准状况下,等质量的A与B的体积比为n∶m
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述正确的是( )
A.18g水中所含的电子数为8NA
B.11.2L氯气所含的分子数为0.5NA
C.2.4gMg与足量的盐酸反应失去的电子数为0.2NA
D.32g氧气中所含的氧原子数为NA
难度: 简单查看答案及解析
-
下列溶液中Cl-浓度最小的是( )
A.200mL 2mol/L MgCl2溶液 B.1000mL 2.5mol/L NaCl溶液
C.300mL 5mol/L KClO3溶液 D.250mL 1mol/L AlCl3溶液
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,22.4 L H2O含有的分子数为NA
B.500mL 1moL/L的盐酸中含有的HCl分子数为0.5 NA
C.通常状况下,NA 个CO2分子占有的体积约为22.4 L
D.通常状况下,71 g Cl2所含原子数为2 NA
难度: 简单查看答案及解析
-
设NA代表阿伏加德罗常数的数值。下列说法中正确的是( )
A.0.1 mol Cl2与足量NaOH溶液反应,转移电子数为0.2 NA
B.0.1 mol金属钠在过量氧气充分燃烧,生成的化合物中离子总数为0.15 NA
C.常温常压下,100 mL 0.5 mol/L的乙二酸溶液中,总的离子数目大于0.15 NA
D.10 g D2O所含的中子数为4 NA
难度: 简单查看答案及解析
-
若NA表示阿伏加德罗常数,下列叙述正确的是( )
A.1 mol NH3与1 mol OH-所含的质子数均为10NA
B.标准状况下,22.4L CHCl3中含C—H键数目为NA
C.1mol Fe与足量的稀HNO3反应时,转移3NA个电子
D.常温下,pH=13的NaOH溶液中含OH-数目为0.1NA
难度: 简单查看答案及解析
-
NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
A.在 H2O2+Cl2=2HCl+O2反应中,每生成32 gO2,转移4NA个电子
B.一定条件下,56 g Fe与33.6 L Cl2充分反应,转移电子数一定为3NA
C.标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.在1 L 0.2 mol·L-1的硫酸铝溶液中含有的铝离子数为0.4NA
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数值,下列说法中正确的是( )
A.1mol某气体的体积为22.4L,该气体的状况一定是标准状况
B.工业上铜的电解精炼时电解池中每转移1mol电子时阳极上溶解的铜小于0.5 NA
C.1molCl2参加化学反应获得的电子数都是2NA
D.将1molNO2气体在降温后颜色变浅,但其所含的分子数仍然为NA
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是( )
A.标准状况下,5.6L CCl4含有的分子数为0.25NA
B.标准状况下,14 g氮气含有的核外电子数为5NA
C.标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的分子总数均为NA
D.在标准状况下,18gH2O所含有的电子数不是10NA
难度: 中等查看答案及解析
-
中国女药学家屠呦呦因发现青蒿素对疟疾的治疗作用而成为2015年诺贝尔生理医学奖获得者,青蒿素的分子式为C15H22O5,它属于有机物,易溶于乙酸、苯,可溶于乙醇、几乎不溶于水,下列说法不正确的是( )
A.人工合成青蒿素经过了长期的实验研究,实验是化学研究的重要手段
B.从青蒿中提取青蒿素的方法是以萃取原理为基础,萃取是一种物理变化
C.可以用苯把溶解在乙醇中的青蒿素萃取出来,静置分层后,下层为苯的青蒿素溶液
D.现代化学分析测试中,可用元素分析仪确定青蒿素中的C、H、O元素
难度: 中等查看答案及解析
-
在标准状况下,下列气体含有的分子数最多的是:( )
A.36.5g HCl B.22.4L O2 C.4g H2 D.0.5mol SO2
难度: 中等查看答案及解析
-
为达到相应的实验目的,下列实验的设计或操作最合理的是( )
A. 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀
B. 在一个集气瓶中收集满CO2气体,取一小段除去表面氧化膜的Mg条用坩埚钳夹持点燃后迅速投入上述集气瓶中,取出坩埚钳,盖上玻璃片,观察Mg条在集气瓶底部燃烧。
C. 为比较Cl与S元素非金属性强弱,相同条件下测定相同浓度NaCl溶液和Na2S溶液的pH值
D. 给盛有铜与浓硫酸的试管加热,发现试管底部出现灰白色固体,为检验其中的白色固体为无水硫酸铜,可直接向试管中加入适量水
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下面叙述正确的是 ( )
A.标准状况下,11.2L SO3所含分子数为0.5 NA
B.1L 1mol/L的氯化钠溶液中,所含离子数为NA
C.常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3 NA
D.一定量的铜与足量的浓硫酸反应,放出2.24L气体时,转移电子数为0.2 NA
难度: 困难查看答案及解析

