-
下列说法正确的是( )
A.石炭酸、氨水、苏打和干冰分别属于酸、碱、盐和氧化物
B.鼠李糖、重晶石和冰醋酸分别属于非电解、强电解质和弱电解质
C.碘有极其重要的生理作用,多多摄入高碘的食物对人体有益
D.为了防止食品受潮及氧化变质,常在包装袋中加入无水硫酸铜和还原铁粉难度: 中等查看答案及解析
-
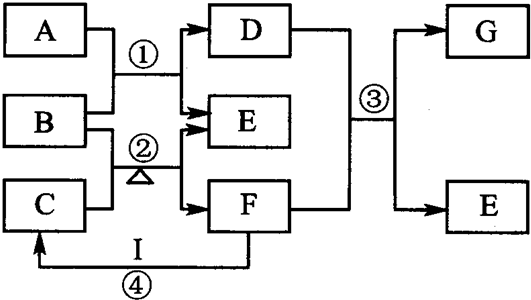
把3g甲醛气体溶于6g冰醋酸中,再加入4g果糖得混合物甲;另取5g甲酸酯和9g葡萄糖相混合得混合液乙;然后将甲和乙两种混合液再按7:4的质量比混合得丙.丙中碳元素的质量分数是( )
A.20%
B.35%
C.40%
D.55%难度: 中等查看答案及解析
-
有A、B、C、D、E、F六瓶不同物质的溶液,它们各是NH3•H2O、Na2CO3、MgSO4、NaHCO3、HNO3和BaCl2溶液中的一种.为了鉴别它们,各取少量溶液进行两两混合,实验结果如右表所示.表中“↓”表示生成微溶物或沉淀,“↑”表示生成气体,“-”表示观察不到明显现象,空格表示实验未做.试推断其中F是( )
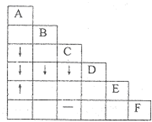
A.Na2CO3溶液
B.BaCl2溶液
C.MgSO4溶液
D.NaHCO3溶液难度: 中等查看答案及解析
-
下列说法或表示法正确的是( )
A.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(1);△H=-258.8kJ•mol-1
B.等量的白磷蒸气和白磷固体分别完全燃烧,后者放出热量多
C.根据中和热△H=-57.3kJ•mol-1,可知将含0.5molH2SO4的溶液与含1molNaOH的溶液混合,放出的热量一定等于57.3kJ
D.由C(S,石墨)═C(S,金刚石);△H=+1.9kJ•mol-1可知,石墨比金刚石稳定难度: 中等查看答案及解析
-
对于可逆反应:2A(g)+B(g)⇌2C(g);△H<0,下列各图正确的是(设变化过程中物质的聚集状态没有发生改变)( )
A.
B.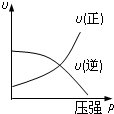
C.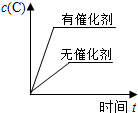
D.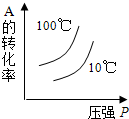
难度: 中等查看答案及解析
-
用Pt作电极,电解串联电路中分装在甲、乙两个烧杯中的200mL0.3mol/LNaCl溶液和现300mL0.15mol/L的AgNO3溶液,当甲中产生0.56L(标准状况)Cl2时停止电解,取出电极,将两杯溶液混合,混合液在室温下的pH为(设混合后总体积为500mL,且所产生的Cl2全部逸出)( )
A.2
B.7
C.11.7
D.12难度: 中等查看答案及解析
-
在化学反应中,有时存在“一种物质过量,另一种物质仍不能完全反应”的情况.下列反应中属于这种情况的是( )
①过量的锌与浓硫酸反应②过量的氢气与少量的N2在工业生产条件下③过量的浓盐酸与碳酸钙反应④过量的乙酸和少量乙醇在浓硫酸、加热条件下⑤过量二氧化锰与浓盐酸在加热条件下⑥过量的铜与浓硫酸在加热条件下.
A.②③④⑥
B.②④⑤⑥
C.①②④⑤
D.③④⑤⑥难度: 中等查看答案及解析
-
下列各项表述中正确的是( )
A.由AlO2-与CO32-在溶液中可以共存,推测:AlO2-与HCO3-在溶液中可以共存
B.足量的氢氧化钙溶液中滴加少量的碳酸氢镁:Ca2++2OH-+2HCO3-+Mg2+=CaCO3↓+2H2O+MgCO3↓
C.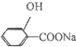 +Na2CO3→
+Na2CO3→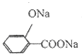 +NaHCO3
+NaHCO3
D.碳酸钙溶于醋酸:CaCO3+2H+=Ca2++CO2↑+H2O难度: 中等查看答案及解析