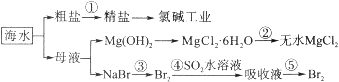
-
化学与生活、社会密切相关。下列说法不正确的是( )
A.可利用废油脂制肥皂
B.合金中可能含有非金属元素
C.水玻璃可用于制造木材防火剂
D.煤经气化和液化的物理变化可变为清洁燃料
难度: 简单查看答案及解析
-
下列化学用语或图示表达正确的是( )
A.乙烯的比例模型
B.Na+的结构示意图
C.葡萄糖的实验式C6H12O6
D.CO2的电子式
难度: 简单查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700℃时制造出纳米级金刚石粉末。该成果发表在世界权威的《科学》杂志上,立刻被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些理解,其中错误的是( )
A.金刚石属于金属单质
B.制造过程中元素种类没有改变
C.CCl4是一种化合物
D.这个反应是置换反应
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数。下列说法正确的是( )
A.7.8 g Na2O2中含有的阴离子数目为0.2NA
B.标准状况下,2.24 L CHCl3的分子数为0.1NA
C.1 L 0.1 mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA
D.0.1 mol Fe与足量稀HNO3反应,转移电子数为0.3NA
难度: 中等查看答案及解析
-
五种短周期元素的某些信息如表所示:
元素
有关信息
X
最高价氧化物对应的水化物能与其气态氢化物反应生成盐
Y
M层上有3个电子
Z
短周期元素中原子半径最大的主族元素
W
其单质是淡黄色固体
Q
最高正价与最低负价代数和为6
下列说法正确的是( )
A.简单离子的半径大小顺序为W>Q>Z>Y
B.Z单质在氧气中燃烧后的产物不能使品红溶液褪色
C.单质熔点高低的顺序为Z>Y>X
D.Z与W元素只能形成原子个数比为2∶1的化合物
难度: 中等查看答案及解析
-
下图是某有机物分子的简易球棍模型,该有机物中含C、H、O、N四种元素。下列关于该有机物的说法中错误的是( )

A.分子式为C3H7O2N
B.能通过聚合反应生成高分子化合物
C.能发生取代反应
D.该有机物能跟NaOH溶液反应,但不能和盐酸反应
难度: 中等查看答案及解析
-
已知HCN的电离常数K=6.2×10-10,用物质的量都是0.1 mol的HCN和NaCN混合后配成1 L溶液,经测定溶液呈碱性.则下列关系式正确的是( )
A.c(CN-)>c(Na+)
B.c(CN-) > c(HCN)
C.c(HCN)+c(CN-)=0.2 mol·L-1
D.c(CN-)+c(OH-)=0.1 mol·L-1
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中可能大量共存的是( )
A.0.l mol·L-1的NaAlO2溶液:K+、Na+、SO42-、CO32-
B.使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl-
C.含有大量ClO- 溶液中:K+、OH-、I-、SO32-
D.c(Al3+)=0.1 mol·L-1的溶液中:Na+、Cl-、AlO2-、SO42-
难度: 困难查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.锌片插入硝酸银溶液中:Zn + Ag+=Zn2++Ag
B.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
C.少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑
D.碳酸氢钙溶液加到醋酸中:HCO3-+H+=CO2↑+H2O
难度: 中等查看答案及解析
-
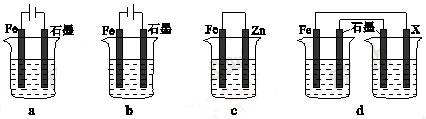
下图所示的实验,能达到实验目的的是 ( )
A
B
C
D
验证化学能
转化为电能
证明温度
对平衡移动的影响
验证铁
发生析氢腐蚀
验证AgCl
溶解度大于Ag2S
难度: 中等查看答案及解析
-
贵州凤岗的“富锌富硒”茶已享誉全国,因富含硒元素,有延年益寿、抗衰老等作用。但研究表明单质硒可能成为环境污染物,通过与浓盐酸、浓H2SO4反应可回收Se。在回收过程中涉及到如下两个化学反应:①SeO2+4KI+4HCl=Se+2I2+4KCl+2H2O;②Se+2H2SO4(浓)=2SO2
+ SeO2+2H2O。下列叙述正确的是( )
A.反应①中Se是氧化产物,I2是还原产物
B.反应②中浓H2SO4是氧化剂,SeO2是还原产物
C.反应①中每有1.0mol I2生成,转移电子数目为4 NA
D.SeO2、H2SO4(浓)、I2的氧化性由强到弱的顺序是H2SO4(浓)> SeO2> I2
难度: 极难查看答案及解析
-
下列图示与对应的叙述相符的是( )
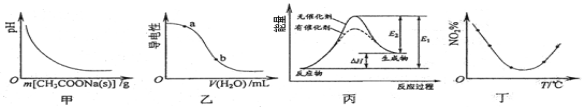
A.图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B.图乙表示向CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b
C.图丙表示催化剂能改变化学反应的焓变
D.图丁表示等量NO2在容积相同的恒容密闭容器中,不同温度下分别发生反应:2NO2(g)
N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0
难度: 困难查看答案及解析
-
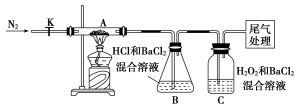
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如下图所示。下列说法中,正确的是( )
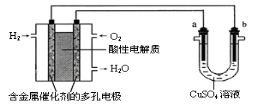
A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e-= 4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下a极产生的气体与电池中消耗的H2体积相等
难度: 困难查看答案及解析
-
亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是( )
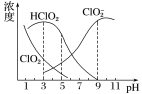
A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10-6
C.使用该漂白剂的最佳pH为3
D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
难度: 极难查看答案及解析