下列溶液中有关微粒的物质的量浓度关系正确的是
A.pH=4的0.1 mol·L-1的NaHA溶液中:c(HA-)>c(H+)>c(H2A)>c(A2-)
B.NaHSO3和NaHCO3两溶液混合呈中性的溶液中(S和C均用R表示):
c(Na+)=c(HRO3-)+2c(RO32-)
C.常温下,等物质的量浓度的三种溶液:①(NH4)2CO3 ②(NH4)2SO4 ③(NH4)2Fe(SO4)2中c(NH4+):①<③<②
D.常温下,将醋酸钠、盐酸两溶液混合呈中性的溶液中: c(Na+)>c(Cl—)=c(CH3COOH)
难度: 简单查看答案及解析
下列表述错误的是
A.太阳能电池可采用硅材料制作,其应用有利于环保、节能
B.提前建成的三峡大坝使用了大量水泥,水泥是新型无机非金属材料
C.用ClO2取代Cl2对饮用水消毒,效果更好
D.“雨后彩虹”“海市蜃楼”既是一种自然现象又是光学现象,也与胶体的知识有关
难度: 简单查看答案及解析
化学与科学、技术、社会、环境密切相关。下列说法不正确的是
A.SiC的硬度很大,可用作砂纸、砂轮的磨料
B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
C.常温下浓硝酸与铝不反应,可用铝制容器存放浓硝酸
D.过氧化钠能与二氧化碳反应产生氧气,可用作高空飞行或潜水的供氧剂
难度: 简单查看答案及解析
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.0.1mol/L的氯化铝溶液中含有的氯离子数为0.3NA
B.常温下,1 molO2和O3的混合气体中所含氧原子数为2.5NA
C.标准状况下,11.2 L的乙烯中含有的共用电子对数为NA
D.13.0 g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.2NA
难度: 简单查看答案及解析
短周期元素A、B、C、D的原子序数依次递增,它们的原子序数之和为32,且原子最外层电子数之和为10;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是
A.四种元素的原子半径:C>D>B>A
B.最高价氧化物对应的水化物的酸性:D>B
C.C元素处于元素周期表中第3周期第ⅡA族
D.B、D的最高价氧化物中,B、D与氧原子之间均为单键
难度: 简单查看答案及解析
某药物分子结构简式如下图所示,下列关于该物质的说法不正确的是
A. 分子式为C21H20O3Cl2
B.  醚键上的氧原子至少与另外11个原子共面
醚键上的氧原子至少与另外11个原子共面
C. 分子中不存在手性碳原子
D. 在一定条件下可发生加成、取代、氧化反应
难度: 中等查看答案及解析
下列离子方程式正确的是
A.用两个铜电极电解稀盐酸:2H+ + 2Cl- H2↑ + Cl2↑
B.向Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O
C.NaHCO3溶液与NaAlO2溶液混合产生白色沉淀AlO2- +HCO3- +H2O = Al(OH)3↓ + CO2
D.向Na2FeO4溶液中加入稀硫酸,迅速反应产生Fe2(SO4)3:
4FeO42-+20 H+=4Fe3++3O2↑+10H2O
难度: 中等查看答案及解析
在一密闭容器中进行如下可逆反应H2(g)+I2(g)2HI(g),达到平衡时,下列有关说
法不正确的是
A.恒温加压,该化学平衡一定不移动
B.其它条件不变,当加入与初始投入量相同量的氢气和碘蒸气,达到平衡后HI的百分含量增大
C.升温,此化学平衡肯定会发生移动
D.在原平衡基础上,恒容,充入氢气,达到新平衡时逆反应速率也会增大
难度: 中等查看答案及解析
某溶液能使红色的石蕊试纸先变蓝色后褪色,则该溶液中可能大量共存的离子组是
A、K+、I-、AlO2-、HCO3-、MnO4- B、Na+、S2-、NO3-、SO32-、SO42-
C、Fe2+、Al3+、NH4+、NO3-、F- D、K+、Na+、Cl-、ClO-、CO32-
难度: 中等查看答案及解析
用酸性氢氧燃料电池电解苦卤水 (含Cl-、Br-、Na+、Mg2+)的装置如图所示 (a、b为石墨
电极)。下列说法中,正确的是

A.电池工作时,正极反应式为:O2 +2 H2O + 4e-= 4OH-
B.忽略能量损耗,当电池中消耗0.02g H2 时,a 极周围会产生0.02g H2
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.电解时,a 电极周围首先放电的是Br-而不是Cl-,说明当其它条件相同时Br-的还原性强于Cl-
难度: 中等查看答案及解析
制取碘盐的流程如下:
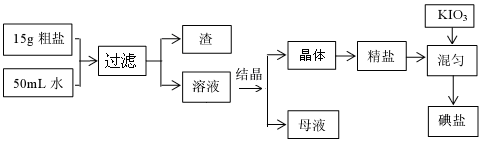
试回答下列问题
(1)检验母液中是否含有SO42-离子的方法是▲ 。
(2)过滤时,用到的玻璃仪器有:▲、▲ 、▲ 。
(3)国家标准GB546061-92规定碘盐含碘量(以碘计),出厂产品≥40mg/Kg。销售品≥30mg/Kg。某次实验时向一干净的坩埚中放入5g精盐,加入1mL0.001mol/L标准KIO3溶液搅拌均匀,在100℃恒温烘干1h,即得碘盐产品,该碘盐的含碘量约为:▲ mg/Kg(保留一位小数),是否是合格产品▲ (填:合格、不合格)。
(4)检验碘盐是否加有碘酸钾,定性检验方法是在酸性介质中加还原剂KCNS,其反应如下:6IO3-+5CNS-+H++2H2O=3I2+5HCN+5SO42-,检验时,除需用KCNS外,还需要的一种试剂,最好是▲ 。
(5)碘盐中的碘酸钾在560℃开始分解产生无色气体,剩余固体加硝酸酸化的硝酸银有黄色沉淀,碘盐在热水中,也会生成两种单质,其中一种是无色气体,滴加酚酞显红色,请写出碘酸钾两种情况下分解的化学方程式:▲ 或▲ 。
难度: 中等查看答案及解析
以硫酸工艺的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:

(1)生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是▲ 。
(2)下列有关说法正确的是▲ 。
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4CCaS +4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是
▲ 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫
酸铵反应的化学方程式▲ 。
难度: 中等查看答案及解析
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒
性金属,试回答下列相关问题.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。
主要反应为:2ZnS +3O22ZnO+2SO2 ;鼓风炉中:2C +O2
2CO
鼓风炉中:ZnO+COZn + CO2
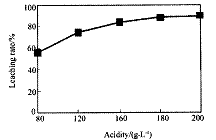
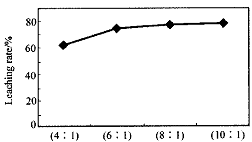
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对些研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2
|
①当酸度为196时,其物质的量浓度为 ________▲________。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:________▲ 、 ▲ 。
(2)湿法炼锌的主要工艺流程为:
①硫酸浸取的主要反应的离子方程式为:________▲________。
②从保护环境和充分利用原料角度,如何处理或利用烟气________▲________。
③除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式________▲________。
④酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式 ▲________、________▲ 。
难度: 中等查看答案及解析
空气中微量的臭氧对人有益,浓度过大则是一种污染气体,臭氧作为强氧化剂,几乎能与任何生物组织反应。
(1)下列有关说法正确的是▲ 。
A.停止使用氟里昂是为保护臭氧层
B.光化学烟雾与大气臭氧的生成有关
C.家用电器消毒柜中产生的臭氧能够高效杀菌消毒
D.臭氧能使湿润的碘化钾-淀粉试纸变蓝
(2)臭氧的化学性质极不稳定,在空气和水中都会慢慢分解成氧气, 臭氧常用于自来水的消毒,臭氧的溶解度及在水中的分解速度与水温及水的pH关系如下图:
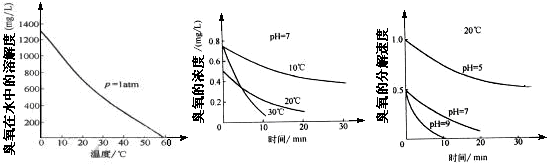
用臭氧消毒自来水,适宜的条件是▲ 。
(3)2O3(g) →3O2(g) △H=-285kJ/mol, 2Ag2O(s) = 4Ag(s)+ O2(g)△H=62.2 kJ/mol,臭氧能与银化合为Ag2O,该反应的热化学方程式为:▲ 。
(4)臭氧在有机合成有广泛用途,可将烯烃氧化为醛同时生成氧气,试写出2-丁烯与臭氧反应的化学方程式:▲ 。
难度: 中等查看答案及解析
 盐酸西替利嗪在临床上广泛用于呼吸系统、皮肤和眼部过敏性疾病,它的一种合成路线如下:
盐酸西替利嗪在临床上广泛用于呼吸系统、皮肤和眼部过敏性疾病,它的一种合成路线如下:
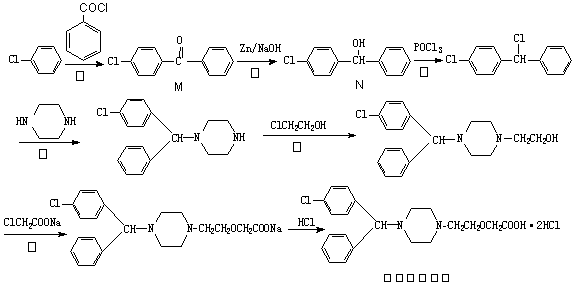 (1)上述反应中,属于取代反应的是▲ (填序号).
(1)上述反应中,属于取代反应的是▲ (填序号).
(2)物质M核磁共振氢谱有▲ 个峰。
(3)盐酸西替利嗪中含氧官能团是▲ (写名称)。
(4)反应④中会产生一种含氮副产物,最有可能是▲ 。
(5)图中物质N符合下列条件的异构体有▲ 种。
①能与氯化铁溶液发生显色反应 ②含有-CH2Cl ③含有联苯()结构。
(6)抗血栓药氯吡格雷的手性合成如下:

已知X的分子式为:C9H8Cl2O2,则X的结构式为▲ 。氯吡格雷中手性碳原子数目为________▲ 个。
(7)已知:
试以中药材大青叶的提取物 (紫苏醛)和甲醇为原料合成(紫苏
酸甲酯) 试写出合成路线。合成路线流程图示例如下:
难度: 中等查看答案及解析
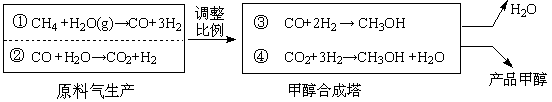
某煤化厂设计了如下清洁生产工艺,先用两种方法同时生产原料气,再调整①②的比例,合成塔中催化剂为CuO/ZnO/Al2O3/V2O3)。该催化剂在250℃和5MPa的操作条件下表现出很好的活性。合成气经循环利用,最终碳元素全部转变甲醇,排空的只有水蒸气,合成原理简图为:
试回答下列问题
(1)工业上用的催化剂由CuO和ZnO组成(质量比为1∶1),最终体系中含二氧化碳, Cu2O的比例也保持相对恒定,从平衡角度考虑,该反应的化学方程式为:
________▲________。
(2)参考CO+2H2CH3OH的平衡常数,工业上采用稍高的压强(5MPa)和250℃,其可能原因是: ▲________。

(3)为使①和②中CO、CO2及H2合成甲醇时原子利用率最高,且各物质均无剩余(假定转化率为100%)。反应①产生的气体与反应②产生的气体最佳体积比为▲ 。
(4)某合作学习小组的同学按照上题(3)的结论,取①的产物与②的产物混合气体67.2L(标准状况),其中CO的体积分数为x ,通过模拟装置合成,得到甲醇的物质的量随CO体积分数变化的函数关系式,并作出图象 (假定CO先与H2反应,CO完全反应后,CO2才与H2反应,且各步转化率均为100%)。
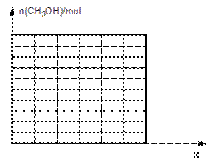
难度: 中等查看答案及解析
已知LiH、NaH及LiAlH4都是常见的金属的氢化物,其中LiAlH4可由下列途径合
成: 4LiH + AlCl3 LiAlH4+ 3LiCl。
试探究下列相关问题
(1)下列有关说法正确的是________▲ 。
A.该反应是氧化还原反应
B.乙醚(C2H5OC2H5)是非极性分子
C.化学性质锂与镁相似,铝与铍相似
D.LiAlH4具有还原性
(2)镧镍合金、铜钙合金及铈钴合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力,其中铜钙合金的晶胞结构为:
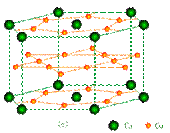
试回答下列问题
①在周期表中Ca处于周期表▲ 区。
②铜原子的基态核外电子排布式为:▲ 。
③已知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5的合金(氢进入晶胞空隙,体积不变),则LaNin中,n= ▲ (填数值);氢在合金中的密度为:▲ 。
(3)中美科学家合作发现钙和锶在C60上吸附很强,可以均匀地覆盖在C60表面上,形成M32C60。非常适于实际应用。 Ca32C60上可吸附至少92个氢分子(如图)。

有关说法正确的是________▲________。
A.钙的第一电离能和电负性均比锶的第一电离能小
B.C60中碳原子杂化方式为sp3
C.Ca32C60储氢是与H2发生加成反应
D.吸附相同数目氢分子时, 储氢质量分数(wt%。)Ca32C60 比Sr32C60高
难度: 中等查看答案及解析
利用化学原理可以对工厂排放的废水进行有效检测和合理处理。
(1)染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润红色石蕊试纸变蓝的气体)。除去NO2-离子的离子方程式是________
________▲________。
(2)废水中的N、P元素是造成水体富营养化的主要因素,农药厂排放的废水中常含有较多的NH4+和PO43-,一般可以通过两种方法将其除去。
①方法一:将Ca(OH)2或CaO投加到待处理的废水中,生成磷酸钙,从而进行回收。当处理后的废水中c(Ca2+)=2×10-7mol/L时,溶液中c(PO43-)=________▲________
(已知常温时,KSP[Ca3(PO4)2]=2×10-33)
②方法二:在废水中加入镁矿工业废水,就可以生成高品位的磷矿石——鸟粪石,反应的方程式为Mg2++ NH4++ PO43-= MgNH4 PO4。该方法中需要控制污水的pH为7.5-10,若pH高于10.7,鸟粪石的产量会大大降低。其原因可能是 ________▲________。与方法一相比,方法二的优点是▲________ 。
(3)三氯乙烯在印刷、纺织等行业应用广泛,为了减少其对环境的影响,可将三氯乙烯在二氧化钛薄膜上催化降解,其反应的机理如下:
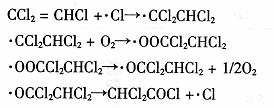
该反应的总化学方程式为________▲________。
难度: 困难查看答案及解析