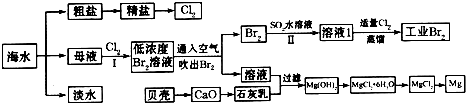
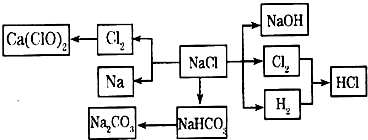
-
下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中
B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中
D.SO2通入已酸化的Ba(NO3)2溶液中难度: 中等查看答案及解析
-
下列物质的水溶液能导电,且属于非电解质的是( )
A.酒精
B.Cl2
C.NH4NO3
D.SO2难度: 中等查看答案及解析
-
取少量无机盐溶液试样对其中的离子进行检验.下列判断正确的是( )
A.加入盐酸,产生白色沉淀,则试样中一定有Ag+
B.加入盐酸,产生能使澄清石灰水变浑浊的无色气体,则试样中一定有CO32-
C.加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解,则试样中一定有SO42-
D.加入NaOH溶液微热,产生能使湿润的红色石蕊试纸变蓝的气体,则试样中一定有NH4+难度: 中等查看答案及解析
-
将下列物质按酸、碱、盐、氧化物分类排列,正确的是( )
A.硫酸、纯碱、石膏、臭氧
B.硝酸、烧碱、绿矾、干冰
C.碳酸、乙醇、醋酸钠、水
D.磷酸、熟石灰、苛性钾、过氧化钠难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.硅、二氧化硅、硅酸钠是工业上制造光导纤维的主要原料
B.复合材料是将两种或两种以上性质不同的材料经特殊加工而制成的
C.浓硫酸、氯化钙、五氧化二磷、碱石灰等常用作干燥剂
D.氧化铝、碳酸氢钠既能与盐酸反应又能与氢氧化钠反应难度: 中等查看答案及解析
-
下列关于药品的使用和保存,仪器选用正确的是( )
A.
实验室中保存浓硝酸
B.
准确量取9.50 mL稀硫酸
C.
用托盘天平称量NaOH固体
D.
实验室中保存Na2CO3溶液难度: 中等查看答案及解析
-
下列概念的分类标准正确的是( )
A.强酸和弱酸:电离的H+离子数目
B.强电解质和弱电解质:溶液的导电能力强弱
C.浊液、胶体、溶液:分散剂粒径大小
D.氧化剂、还原剂:在化学反应中元素的化合价变化难度: 中等查看答案及解析
-
下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由合金材料制造的
B.生铁、普通钢和不锈钢耐腐蚀性依次减弱
C.镁在空气中燃烧发出耀眼的白光,可用于制作照明弹
D.日用铝制品表面覆盖着氧化膜,对内部金属起保护作用难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.溶液是电中性的,胶体是带电的
B.因为SO2具有还原性,所以不能用浓硫酸干燥SO2
C.本饮品由纯天然物质配制而成,绝对不含化学物质,对人体无害
D.含碘食盐可防止甲状腺肿大难度: 中等查看答案及解析
-
下列有关化工生产和物质的性质应用,说法正确的是( )
A.生产玻璃和水泥都要用到的原料是石灰石和黏土
B.工业上金属Na、Mg、Al都是用电解熔融的氯化物制得的
C.食盐、Br2、Mg(OH)2都可以从海水中提取
D.氯气、漂白粉、明矾都可以用于自来水的消毒难度: 中等查看答案及解析
-
气体X可能含有NH3、Cl2、HBr、CO2中的-种或几种.已知X通入硝酸银溶液时产生淡黄色、不溶于稀硝酸的沉淀,若将X通入澄清石灰水中没有沉淀产生.则下列有关气体X的成分的说法正确的是( )
A.一定含有溴化氢、二氧化碳
B.一定不含二氧化碳
C.一定不含氨气、氯气
D.可能含有二氧化碳和氯气难度: 中等查看答案及解析
-
将铁、铝、硅的混合物分为等质量的两份,一份跟足量的NaOH溶液反应,另一份跟足量稀硫酸反应,最终产生的H2一样多,则铁与硅的物质的量之比为( )
A.2:1
B.4:1
C.1:l
D.3:l难度: 中等查看答案及解析
-
下列变化中起氧化作用和还原作用的元素不是同一种元素的是( )
A.在400℃左右且有催化剂存在的条件下,用氨把一氧化氮还原为氮气
B.工业上用稀硫酸和氧气与单质铜反应制取硫酸铜
C.工业上用石灰乳和氯气制备漂白粉
D.实验室用氯酸钾和浓盐酸制取氯气难度: 中等查看答案及解析
-
下列除去杂质的方法正确的是( )
A.除去N2中的O2:通过灼热的CuO粉末,收集气体
B.除去Cl2中的少量HCl:通过饱和NaCl溶液,收集气体
C.除去FeCl2溶液中的少量FeCl3:加入足量铁屑,充分反应后过滤
D.除去KCl溶液中的少量MgCl2:加入适量NaOH溶液过滤难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.7.8 g Na2O2中含有的离子总数为0.3 NA
B.1 mol FeCl3制成胶体,所得胶体粒子数目为NA
C.pH=13的氢氧化钠溶液中所含Na+为0.1NA
D.5.6 g铁与足量的盐酸反应失去电子数为0.2 NA难度: 中等查看答案及解析
-
下列事实能用同一原理解释的是( )
A.SO2、Cl2均能使品红溶液褪色
B.NH4HCO3晶体、固体碘受热均能变成气体
C.S与铁、铜反应均生成低价硫化物
D.ClO-与S2-、H+均不能大量共存于同一溶液难度: 中等查看答案及解析
-
三氟化氮(NF3)是微电子工业中一种优良的等离子蚀刻气体.它无色,在潮湿的空气中能发生下列反应:3NF3+5H20=2NO+HNO3+9HF.下列说法正确的是( )
A.反应中NF3是氧化剂,H2O是还原剂
B.反应中被氧化与被还原的原子的物质的量之比为2:l
C.若反应生成0.2 mol HNO3,则反应中共转移0.2 mol电子
D.NF3在潮湿的空气中泄漏会产生白雾、红棕色气体等现象难度: 中等查看答案及解析
-
在给定条件下,可以大量共存的离子组是( )
A.含有0.1 mol•L-1 Fe3+的溶液中:H+、Fe2+、Na+、Br-
B.强碱性溶液中:K+、Al3+、Cl-、SO42-
C.在pH=1的溶液中:Mg2+、Na+、ClO-、NO3-
D.加入强碱再加热,既有气体放出又有沉淀生成的溶液:Ca2+、HCO3-、NH4+、Cl-难度: 中等查看答案及解析