-
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)
A 阳极发生还原反应,其电极反应式:Ni2++2e-=Ni
B 电解过程中,阳极质量的减少与阴极质量的增加相等
C 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D 电解后,电解槽底部的阳极泥中只有Cu和Pt
难度: 中等查看答案及解析
-
以下防腐措施中,属于电化学保护法的是( )
A. 用氧化剂使金属表面生成致密稳定的氧化物保护膜
B. 在金属中加入一些铬或者镍制成合金
C. 在轮船的船壳水线以下部分,装上一锌锭
D. 在金属表面喷漆
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. 鼓励使用太阳能、风能等清洁能源能减少PM2.5的污染
B. 与铜质水龙头连接处的钢质水管易发生腐蚀
C. 发酵粉中含有较多的NaHCO3,能使焙制出的糕点疏松多孔
D. 东汉魏伯阳在《周易参同契》中对汞的描述“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里黄芽指的是黄铜
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是 ( )
A. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
B. 已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g) ΔH2;则ΔH2>ΔH1
C. 已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol
D. 放热过程(ΔH<0)或熵增加(ΔS> 0)的过程一定是自发的
难度: 困难查看答案及解析
-
已知通常情况下,1molC(石墨)完全燃烧生成CO2气体时放热393.5KJ,1molCO气体完全燃烧生成CO2气体时放热283.0KJ。下列说法正确的是( )
A. 石墨燃烧生成CO气体的热化学方程式为:2C(石墨)+O2(g)=2CO(g) △H= —110.5kJ/mol
B. C (石墨)不完全燃烧,生成CO2和CO两种气体时,可放热283.0kJ
C. C(石墨)和CO2(g)反应生成CO(g)的反应是吸热反应
D. 若金刚石的燃烧生成CO2气体放出的热量大于石墨,则石墨变成金刚石的变化是放热反应
难度: 中等查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是 ( )
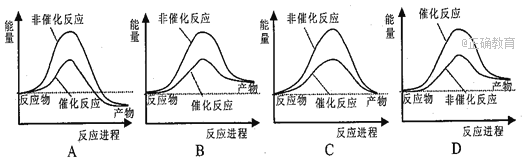
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程。已知键能数据如下表:
化学键
N≡N
N—H
H—H
键能(kJ/mol)
942
391
b
反应N2(g)+3H2(g)
2NH3(g);△H= —93kJ·mol-1。试根据表中所列键能数据计算b数值:
A. 551 B. 437 C. 558 D. 160
难度: 中等查看答案及解析
-
关于电解NaCl水溶液,下列叙述正确的是
A. 电解时在阳极得到氯气,在阴极得到金属钠
B. 若在阳极附近的溶液中滴入KI试液,溶液呈棕色
C. 若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D. 电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
难度: 简单查看答案及解析
-
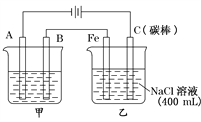
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的()
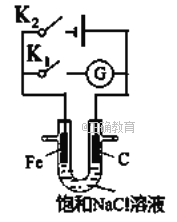
A. K1闭合,铁棒上发生的反应为2H++2e-=H2↑
B. K1闭合,石墨棒周围溶液碱性增强
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
难度: 中等查看答案及解析
-
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2下列有关该电池的说法不正确的是()
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+20H--2e-=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的碱性减弱
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
难度: 中等查看答案及解析
-
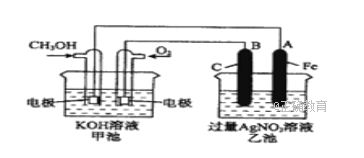
用两根铂丝作电极插入KOH溶液中,再分别向两极通入甲烷气体和氧气,可形成燃料电池,该电池放电时的总反应为:CH4+2KOH+2O2═K2CO3+3H2O,下列说法错误的是( )
A. 放电一段时间后,KOH的物质的量不发生变化
B. 放电时通入氧气的一极附近溶液的碱性增强
C. 通甲烷的一极为负极,通氧气的一极为正极
D. 通甲烷的电极反应式是:CH4+10OH--8e-═CO32-+7H2O
难度: 简单查看答案及解析
-
在2A(g) +B(g)=3C(g) +4D(g)反应中,表示该反应速率最快的是( )
A. v(A)=0.5mol·(L· s)-1 B. v(B)=0.3 mol·(L· s)-1
C. v(C)=0.8 mol·(L· s)-1 D. v(D)=1 mol·(L· s)-1
难度: 中等查看答案及解析
-
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( )
A. 水既是氧化剂又是溶剂 B. 放电时正极上有氢气生成
C. 放电时OH-向正极移动 D. 总反应为:2Li+2H2O=== 2LiOH+H2↑
难度: 中等查看答案及解析
-
过程的自发性的作用是()
A. 判断过程的方向 B. 确定过程是否一定会发生
C. 判断过程发生的速率 D. 判断过程的热效应
难度: 简单查看答案及解析
-
在2L的密闭容器中,发生以下反应:2A(g)+ B(g)
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
难度: 中等查看答案及解析
-
一定条件下反应2AB(g)⇌A2(g)+B2(g)达到平衡状态的标志是()
A. 单位时间内生成3n molA2,同时消耗2n molAB
B. 容器内,3种气体AB、A2、B2共存
C. AB的消耗速率等于A2的消耗速率
D. 容器中各组分的物质的量分数不随时间变化
难度: 中等查看答案及解析
-
反应A(g)+2B(g)==C(g)的反应过程中能量变化如下图所示。下列相关说法正确的是 ( )
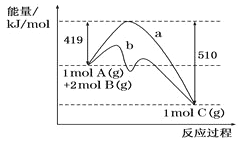
A. 正反应活化能大于逆反应活化能
B. 曲线b表示使用催化剂后的能量变化
C. 由图可知该反应的焓变△H=+91kJ/mol
D. 反应中将气体A换为固体反应,其他条件不变,反应放出热量大于91kJ
难度: 中等查看答案及解析
-
如图所示实验装置,下列说法不正确的是
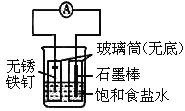
A.装置为铁的吸氧腐蚀实验
B.一段时间后,向插入铁钉的玻璃筒内滴入NaOH溶液,即可观察到铁钉附近的溶液有沉淀
C.向插入石墨棒的玻璃筒内滴入石蕊试液,可观察到石墨附近的溶液变红
D.若将装置中饱和食盐水换成稀硫酸,装置为析氢腐蚀
难度: 中等查看答案及解析
-
在密闭容器中进行如下反应:X2(g)+Y2(g)⇌2Z(g),已知 X2、Y2、Z的起始浓度分别为 0.1mol/L,0.3mol/L,0.2mol/L,在一定的条件下,当反应达到平衡时,各物质的浓度有可能是()
A. Z为0.3mol/L B. Y2为0.4mol/L C. X2为0.2mol/L D. Z为0.4mol/L
难度: 中等查看答案及解析
-
下列各变化中属于原电池反应的是( )
A. 在空气中金属铝表面迅速氧化形成保护层
B. 镀锌铁表面有划损时,也能阻止铁被氧化
C. 红热的铁丝与冷水接触,表面形成蓝黑色保护层
D. 浓硝酸比稀硝酸更能氧化金属铜
难度: 中等查看答案及解析
-
下面有关电化学的图示,完全正确的是( )
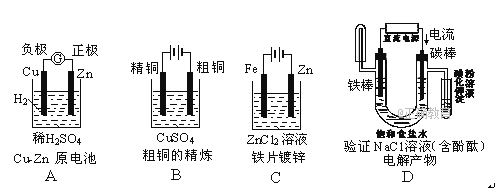
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
沼气是一种能源,它的主要成分是CH4。0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量。则下列热化学方程式中正确的是
A. 2CH4 ( g )+4O2 ( g ) = 2 CO2 ( g ) + 4H2O ( l ) ΔH = +890 kJ/mol
B. CH4+2 O2= CO2+ H2O ΔH = -890 kJ/mol
C. CH4 (g )+2 O2 ( g ) = CO2 ( g ) + 2 H2O ( l ) ΔH = -890 kJ/mol
D. 1/2 CH4 ( g )+O2 ( g ) = 1/2 CO2 ( g ) + H2O ( l ) ΔH = -890 kJ/mol
难度: 中等查看答案及解析
-
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如右图。下列有关氢氧燃料电池的说法不正确的是
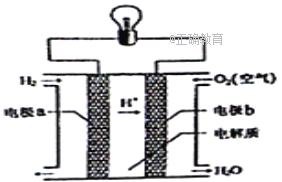
A. 该装置将化学能转化为电能
B. 为了增加灯泡亮度,可以将电极碳棒变得粗糙多孔
C. 电子迁移方向:电极a→灯泡→电极b→电解质溶液→电极a
D. 该电池的总反应:2H2+O2=2H2O
难度: 困难查看答案及解析