-
下列物质不需要密封保存的是
A.氢氧化钠 B.浓盐酸 C.浓硫酸 D.氯化钠
难度: 简单查看答案及解析
-
下列属于纯净物的是
A.加碘食盐 B.干冰 C.硬水 D.食醋
难度: 中等查看答案及解析
-
空气成分中,体积分数最大的是
A.氧气 B.氮气 C.二氧化碳 D.稀有气体
难度: 简单查看答案及解析
-
下列过程,属于物理变化的是
A.蜡烛燃烧 B.面团发酵 C.酒精挥发 D.燃放烟花
难度: 中等查看答案及解析
-
下列金属活动性最强的是
A.Fe B. Ag C.Cu D. Zn
难度: 困难查看答案及解析
-
下列物质中,含有氧分子的是
A.河水 B.高锰酸钾 C.水 D.双氧水
难度: 中等查看答案及解析
-
下列化学反应,属于复分解反应的是
A.C + 2CuO
2Cu + CO2↑ B.2H2O2
2H2O+O2↑
C.C2H5OH + 3O2
2CO2 + 3H2O D.Na2CO3 +Ca(OH)2 === CaCO3↓+ 2NaOH
难度: 中等查看答案及解析
-
春天里那个百花香”,能闻到花香的原因是
A.分子在不断运动 B.分子间有间隔
C.分子的质量很小 D.分子由原子构成
难度: 中等查看答案及解析
-
一种铁原子的原子核内有26个质子和30个中子,该原子的核外电子数为
A.56 B.30 C.26 D.4
难度: 中等查看答案及解析
-
下列符号能表示2个氧分子的是
A.2O2 B.2O C. O2 D.2O2-
难度: 中等查看答案及解析
-
下列化学方程式书写正确的是
A.3Fe + 2O2
Fe3O4 B.2H2O
2H2↑ + O2↑
C.2Mg + O2 === 2MgO D.H2SO4 + NaOH === NaSO4 + H2O
难度: 中等查看答案及解析
-
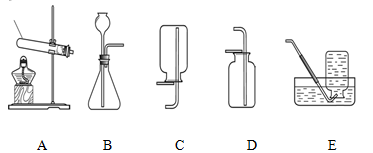
下列实验操作正确的是
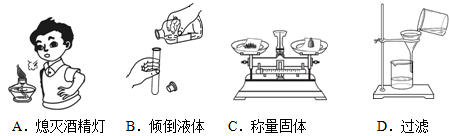
难度: 中等查看答案及解析
-
下列物质的用途中,利用其物理性质的是
A.干冰用作冷冻剂 B.硫酸用于处理碱性废液
C.氧气用于气焊 D.生石灰用作干燥剂
难度: 中等查看答案及解析
-
下列关于水的组成的说法中,不正确的是
A.水由水分子构成 B. 水由氢原子和氧原子构成
C.水由氢、氧两种元素组成 D.一个水分子由两个氢原子和一个氧原子构成
难度: 中等查看答案及解析
-
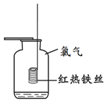
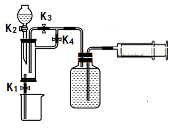
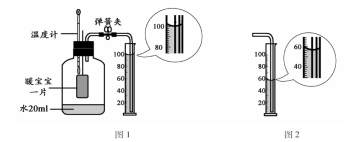
某同学利用右图所示装置探究燃烧的条件(热水温度远高于白磷着火点)。下列说法不正确的是
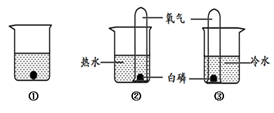
A.①中水为热水
B.②中白磷燃烧
C.①和③对比可以得出燃烧的条件之一
D.②和③对比可以得出燃烧的条件之一
难度: 中等查看答案及解析
-
下列实验操作,不能达到实验目的的是
选项
实验目的
实验操作
A
验证NaCl溶液中混有盐酸
取少量溶液,滴加无色酚酞溶液
B
鉴别O2和N2
伸入带火星的木条
C
除去铁制品上的铁锈
将铁制品浸泡在足量的稀硫酸中
D
除去氢氧化钠中混有的碳酸钠
滴加适量石灰水,过滤
难度: 中等查看答案及解析
-
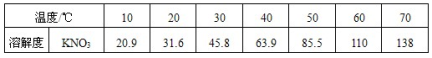
甲、乙两种固体的溶解度曲线如右图所示。下列说法中,正确的是
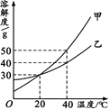
A.20℃时,甲、乙溶液中溶质的质量分数相等
B.40℃时,分别在100 g水中加入50 g 甲、乙,所得溶液均为饱和溶液
C.将40℃甲和乙的饱和溶液降温到20℃,析出甲的质量更多
D.20℃时,分别在100 g水中加入50 g 甲、乙,再升温至40℃,所得溶液溶质质量分数相同
难度: 中等查看答案及解析
-
甲和乙在点燃条件下反应生成丙和丁,其微观过程如下图所示。
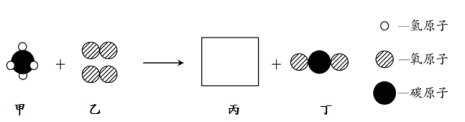
下列说法中,不正确的是
A.丙的分子结构为
B.四种物质中,只有甲属于有机物
C.丁中两种元素的质量比为3:8 D.生成丙和丁的质量比为9:22
难度: 中等查看答案及解析
-
下列4个图像能正确反映对应变化关系是
A
B
C
D

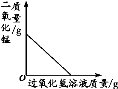
向一定量稀H2SO4中加入NaOH溶液
用酒精灯加热一定量KMnO4固体
将水通电电解一段时间
向一定量的二氧化锰中加入H2O2溶液
难度: 中等查看答案及解析
-
下图为化学小组探究金属的化学性质所做的四个实验。回答下列问题:
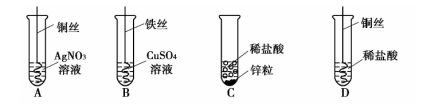
(1)写出溶液变蓝的反应的化学方程式________。
(2)由上述实验能得出金属的活动性顺序是_________。
难度: 中等查看答案及解析