-
对于反应2C4H10(g) + 13O2(g) == 8CO2(g) + 10H2O(l);△H= -5800kJ/mol下列叙述错误的是( )
A. 该反应的反应热为△H= -5800kJ/mol,是放热反应;
B. 该反应的△H与各物质的状态有关,与化学计量数也有关;
C. 该式的含义为:25℃、101kPa下,2mol C4H10气体完全燃烧生成CO2和液态水时放出热量5800kJ;
D. 该反应为丁烷燃烧的热化学方程式,由此可知丁烷的燃烧热为5800kJ/mol。
难度: 简单查看答案及解析
-
下列有关金属腐蚀与防护的说法不正确的是( )
A.纯银器的表面在空气中因化学腐蚀渐渐变暗
B.当镀锡铁制品的镀层破损时,镀层不能对铁制品起保护作用
C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
难度: 简单查看答案及解析
-
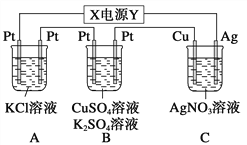
用惰性电极电解下列溶液,其中随着电解的进行,溶液pH逐渐减小的是( )
①氯化钠溶液 ②硫酸铜溶液 ③氢氧化钠溶液 ④稀硫酸 ⑤稀盐酸 ⑥硫酸钠溶液
A. ①③⑤ B. ②④⑤ C. ②④ D. ②④⑥
难度: 中等查看答案及解析
-
在一定条件下,充分燃烧一定量的丁烷放出热量Q kJ(Q>0),经测定完全吸收生成的CO2需消耗5 mol/L的KOH溶液100 mL,恰好生成正盐,则此条件下反应C4H10(g)+13/2O2(g)===4CO2(g)+5H2O(g)的ΔH为
A. +8Q kJ/mol B. +16Q kJ/mol
C. -8Q kJ/mol D. -16Q kJ/mol
难度: 中等查看答案及解析
-
锂离子电池是新型高能电池,它以质量轻、能量高而受到了普遍重视,目前已研制成功多种锂离子电池,某种锂离子电池的总反应为Li+MnO2=LiMnO2,下列说法中正确的是
A. Li是正极,电极反应式为Li−e−=Li+
B. Li是负极,电极反应式为Li−e−=Li+
C. MnO2是负极,电极反应式为MnO2+e−=MnO2−
D. Li是负极,电极反应式为Li−2e−=Li2+
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则1 mol硫酸与足量氢氧化钡溶液反应放热为 114.6 kJ
B. H2(g)的燃烧热是285.8 kJ·mol-1,则2H2O(l)===2H2(g)+O2(g)反应的ΔH=+571.6 kJ·mol-1、
C. 放热反应比吸热反应容易发生
D. 1 mol丙烷燃烧生成水和二氧化碳所放出的热量是丙烷的燃烧热
难度: 中等查看答案及解析
-
下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是
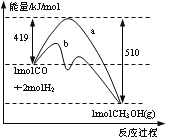
A. 该反应是吸热反应
B. 使用催化剂后反应热减小
C. 热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1
D. 曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
难度: 简单查看答案及解析
-
根据下列热化学方程式:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ/mol
②H2(g)+
O2(g)===H2O(l) ΔH2=-285.8 kJ/mol
③CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH3=-870.3 kJ/mol
可以计算出2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为( )
A.ΔH=+244.1 kJ/mol B.ΔH=-488.3 kJ/mol
C.ΔH=-996.6 kJ/mol D.ΔH=+996.6 kJ/mol
难度: 简单查看答案及解析
-
用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,某电极上产生的ClO-将CN-氧化为两种无污染的气体,下列说法正确的是( )
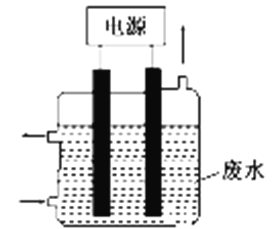
A. 可以用石墨作阳极,铁作阴极
B. 除去CN-的反应式为:2CN-+5ClO-+2H+===N2↑+2CO2↑+5Cl-+H2O
C. 阴极的电极反应式为:Cl-+2OH-+2e-===ClO-+H2O
D. 阳极的电极反应式为:2CN-+12OH--10e-===N2↑+2CO+6H2O
难度: 中等查看答案及解析
-
用酸性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中,正确的是 ( )
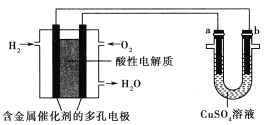
A.燃料电池工作时,正极反应为O2+2H2O+4e-===4OH-
B.此装置用于铁表面镀铜时,a为铁
C.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下,a极产生的气体与电池中消耗的H2体积相等
难度: 中等查看答案及解析
-
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为2H2+O2===2H2O,下列有关说法正确的是( )
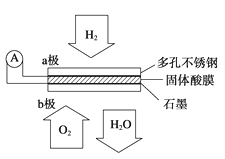
A. 电子通过外电路从b极流向a极
B. b极上的电极反应式为O2+2H2O+4e-===4OH-
C. 每转移0.1 mol电子,便消耗1.12 L的O2
D. H+由a极通过固体酸电解质传递到b极
难度: 困难查看答案及解析
-
如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则以下说法正确的是( )
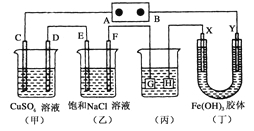
A.电源B极是正极
B.(甲)、(乙)装置的C、D、E、F电极均有单质生成,其物质的量比为1:2:3:2
C.欲用(丙)装置给铜镀银,G应该是Ag,电镀液是AgNO3溶液
D.装置(丁)中X极附近红褐色变浅,说明氢氧化铁胶粒带负电荷
难度: 简单查看答案及解析
-
已知充分燃烧ag乙炔气体生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是( )。
A. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-4bkJ・mol-1
B. C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)ΔH=2bkJ・mol-1
C. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=-2bkJ・mol-1
D. 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)ΔH=bkJ・mol-1
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g) + I2(g)
2HI(g) ΔH=-a kJ·mol-1
已知:
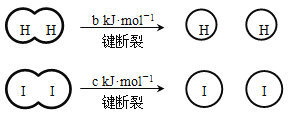 (a、b、c均大于零)
(a、b、c均大于零)下列说法不正确的是( )
A. 反应物的总能量高于生成物的总能量
B. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
难度: 困难查看答案及解析
-
科学家已获得了极具理论研究意义的N 4 分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1 mol N-N键吸收193 kJ热量,断裂1 mol N≡N键吸收941 kJ热量,则()
A. N 4 的熔点比P 4 高
B. 1 mol N 4 气体转化为N 2 时要吸收724 kJ能量
C. N 4 是N 2 的同系物
D. 1 mol N 4 气体转化为N 2 时要放出724 kJ能量
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 右图可表示由CO生成CO2的反应过程和能量关系
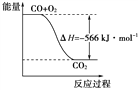
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH > -532 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
含有11.2 g KOH的稀溶液与1 L 0.1 mol•L﹣1的H2SO4溶液反应,放出11.46 kJ的热量,下列热化学方程式正确的是
A. KOH(aq)+
H2SO4(aq) ===
K2SO4(aq)+H2O(l) ΔH =-11.46 kJ•mol﹣1
B. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =-11.46 kJ•mol﹣1
C. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =+114.6 kJ•mol﹣1
D. KOH(aq)+
H2SO4(aq) ===
K2SO4(aq)+H2O(l) ΔH =-57.3 kJ•mol﹣1
难度: 简单查看答案及解析
-
能源问题是人类社会面临的重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ·mol-1、282.5kJ·mol-1、726.7kJ·mol-1。已知CO和H2在一定条件下可以合成甲醇CO(g)+2H2(g)===CH3OH(l)。则CO与H2反应合成甲醇的热化学方程式为( )
A.CO(g)+2H2(g)===CH3OH(l) ΔH=-127.4kJ·mol-1
B.CO(g)+2H2(g)===CH3OH(l) ΔH=+127.4kJ·mol-1
C.CO(g)+2H2(g)===CH3OH(g) ΔH=-127.4kJ·mol-1
D.CO(g)+2H2(g)===CH3OH(g) ΔH=+127.4kJ·mol-1
难度: 简单查看答案及解析
-
分析下图所示的四个原电池装置,其中结论正确的是( )
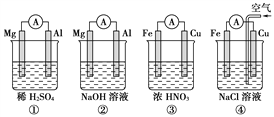
A. ①②中Mg作负极,③④中Fe作负极
B. ②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C. ③中Fe作负极,电极反应式为Fe-2e-===Fe2+
D. ④中Cu作正极,电极反应式为2H++2e-===H2↑
难度: 中等查看答案及解析
-
如图所示,烧杯内盛有浓HNO3,在烧杯中放入用铜线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。下列有关说法正确的是( ) .
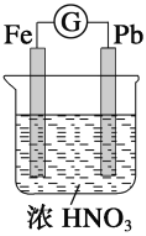
A. Fe比Pb活泼,始终作负极
B. Fe在浓HNO3中钝化,始终不会溶解
C. 电池停止工作时,烧杯中生成了Fe(NO3)3
D. 利用浓HNO3作电解质溶液不符合“绿色化学”思想
难度: 中等查看答案及解析
-
Cu2O是一种半导体材料,基于绿色化学理念设计的制取Cu2O的电解池示意图如右,电解总反应为:2Cu+H2O
Cu2O+H2↑。下列说法正确的是
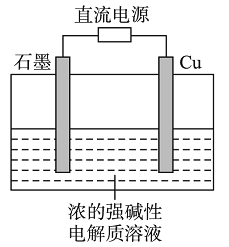
A. 石墨电极上产生氢气
B. 铜电极发生还原反应
C. 铜电极接直流电源的负极
D. 当有0.1 mol电子转移时,有0.1 mol Cu2O生成
难度: 中等查看答案及解析
-
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是(已知:氧化性Fe2+<Ni2+<Cu2+)( )
A. 阳极发生还原反应,其电极反应式:Ni2++2e-==Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,溶液中存在的金属阳离子只有Fe2+和Zn2+
D. 电解后,电解槽底部的阳极泥中只有Cu和Pt
难度: 中等查看答案及解析
-
下列叙述正确的是
A.纯锌与硫酸反应时,加入少量CuSO4溶液,可使反应速率加快
B.甲醇和氧气以及KOH溶液构成的新型燃料电池中,其负极上发生的反应为:CH3OH+6OH- +6e-=CO2 +5H2O
C.在铁件上镀铜时,金属铜作阴极
D.电解精炼铜时电解质溶液中铜离子浓度保持不变
难度: 中等查看答案及解析
-
用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A. AgNO3 [AgNO3] B. NaOH [H2O]
C. KCl [KCl] D. CuSO4 [Cu(OH)2]
难度: 中等查看答案及解析
-
依据下图判断,下列叙述正确的是( )
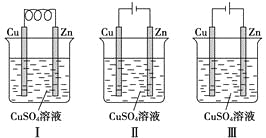
A. Ⅰ是原电池,Ⅱ是电镀装置
B. Ⅰ、Ⅱ装置中锌极上均发生氧化反应
C. Ⅱ、Ⅲ装置中,铜极均发生氧化反应而溶解
D. Ⅱ、Ⅲ装置中Cu2+浓度基本不变
难度: 中等查看答案及解析
-
某溶液中含有溶质NaCl和H2SO4,它们的物质的量之比为3∶1。用石墨作电极电解溶液时,根据电极产物,可明显分为三个阶段。下列叙述不正确的是 ( )
A. 阴极只析出H2 B. 阳极先析出Cl2,后析出O2
C. 电解最后阶段为电解水 D. 溶液pH不断增大,最后为7
难度: 困难查看答案及解析
-
如图所示的A、B两个电解池中的电极均为铂,在A池中加入足量0.05 mol·L-1的CuCl2溶液,B池中加入足量0.1 mol·L-1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是( )
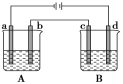
A.2∶2∶4∶1 B.1∶1∶2∶1
C.2∶1∶1∶1 D.2∶1∶2∶1
难度: 困难查看答案及解析
-
下列各种方法中,能对金属起到防止或减缓腐蚀作用的是( )
①金属表面涂抹油漆 ②改变金属内部结构 ③保持金属表面清洁干燥 ④金属表面进行电镀 ⑤使金属表面形成致密的氧化物薄膜
A. ①②③④ B. ①③④⑤
C. ①②④⑤ D. 全部
难度: 简单查看答案及解析
-
下列与金属腐蚀有关的说法正确的是( )
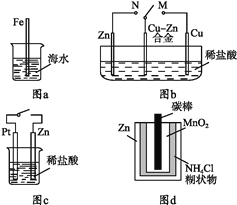
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
难度: 简单查看答案及解析
-
如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )
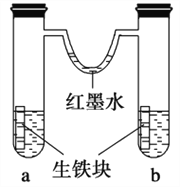
A. 生铁块中的碳是原电池的正极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是 Fe-2e-===Fe2+
D. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
难度: 中等查看答案及解析