-
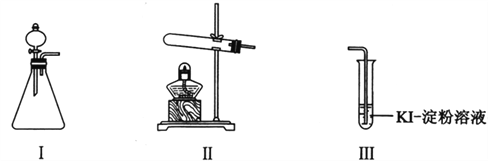
化学与生产、生活密切相关,下列说法正确的是
A. 从海水中获取化学物质均要通过化学变化才能实现
B. 宇宙飞船上的太阳能帆板的主要材料是晶体硅
C. 酸性重铬酸钾用于检查酒驾是利用其强还原性
D. 与矿泉水相比,纯净水更干净,更适合饮用
难度: 中等查看答案及解析
-
2017年12月5日国家食药监总局要求莎普爱思尽快启动临床有效性试验。莎普爱思有效成分是由苄达酸与赖氨酸生成的有机盐,苄达酸结构如图所示。下列关于苄达酸的叙述正确的是

A. 分子式为C16H16N2O3 B. 所有原子可能共平面
C. 苯环上的一氯代物有5种 D. 属于芳香族化合物,且有弱酸性
难度: 中等查看答案及解析
-
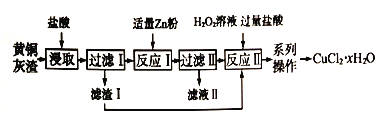
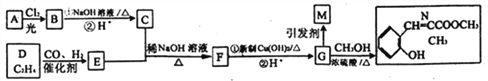
合成氨及其相关工业中,部分物质间的转化关系如下:
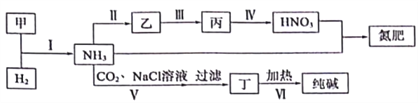
下列说法不正确的是( )
A. 反应Ⅰ、Ⅱ、Ⅲ、Ⅳ均属于氧化还原反应
B. 上述转化中包含了氨气、硝酸、硝铵、小苏打、纯碱的工业生产方法
C. 反应Ⅳ和Ⅵ中的部分产物可在上述流程中循环利用
D. 反应V是先向饱和氯化钠溶液中通CO2至饱和再通NH3
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 0.5mol/L亚硫酸溶液中含有的H+数日小于NA
B. 12g石墨烯(单层石墨)中含有六元环的个数为1.5NA
C. 1.2g镁在足量的氧气中燃烧,转移的电子数为0.1NA
D. lmolSO2和0.5mo102在VL的密闭容器中充分反应,生成SO3的分子数目为NA
难度: 中等查看答案及解析
-
据报道,我国研制出“可充电钠——二氧化碳电池”,电极材料为钠金属片和碳纳米管,电解液为高氯酸钠一四甘醇二甲醚,电池总反应为:4Na+3CO2
2Na2CO3+C生成固体Na2CO3沉积在碳纳米管上,下列叙述不正确的是
A. 放电时钠金属片发生氧化反应
B. 放电时每消耗3mo1C02,转移12mol电子
C. 充电时碳纳米管接直流电源的正极
D. 充电时阳极反应为C+2Na2CO3-4e-=4Na++3CO2↑
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、M、R 的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是
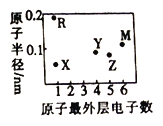
A. 化合物X2M 是弱电解质 B. 化合物RX 中含共价键
C. M的单质在常温下为气体 D. Y、Z 的氧化物均能溶于水
难度: 中等查看答案及解析
-
已知:pKa=-lgKa,25℃时,H2A的pKal=1.85,pKa2=7.19。常温下,用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1H2A溶液的滴定曲线如图所示。下列说法正确的是
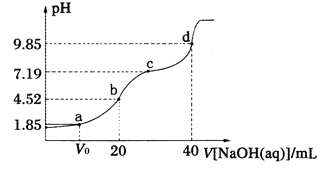
A. a点所得溶液中:V0=10 mL
B. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. c点所得溶液中:c(A2-)=c(HA-)
D. d点所得溶液中A2-水解平衡常数Khl=10-7.19
难度: 困难查看答案及解析