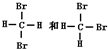-
已知短周期元素的离子.aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
A.原子半径A>B>D>C
B.a-c=1
C.离子半径C>D>B>A
D.单质的还原性A>B>D>C难度: 中等查看答案及解析
-
进行一氯取代后,只能生成三种沸点不同的有机物的烷烃是( )
A.(CH3)2CHCH2CH2CH3
B.(CH3)2CHCH3
C.(CH3)2CHCH(CH3)2
D.(CH3)3CCH2CH3难度: 中等查看答案及解析
-
把Ba(OH)2溶液滴入到明矾[KAl(SO4)2=K++Al3++2SO42-]溶液中,使SO42-全部转化成BaSO4沉淀,此时铝元素的主要存在形式是( )
A.Al3+
B.Al(OH)3
C.AlO2-
D.Al3+和Al(OH)3难度: 中等查看答案及解析
-
下列由事实得出的结论错误的是( )
A.维勒用无机物合成了尿素,突破了无机物与有机物的界限
B.门捷列夫在前人工作的基础上发现了元素周期律,表明科学研究既要继承又要创新
C.美国的赫克、日本的根岸英一和铃木章,发明了“钯催化交叉偶联反应”技术,大大提升合成复杂化学物质的可能性,三位科学家从而获得了2010年诺贝尔化学奖,这体现了国际科技合作的重要性
D.科恩和波普尔因理论化学方面的贡献获诺贝尔化学奖,意味着化学已成为以理论研究为主的学科难度: 中等查看答案及解析
-
下列有机物的命名中正确是( )
A.2,4,4-三甲基戊烷
B.2-乙基丁烷
C.2,2-二甲基丙烷
D.1,3,3-三甲基丁烷难度: 中等查看答案及解析
-
现行元素周期表中已列出112种元素,其中元素种类最多的周期是( )
A.第4周期
B.第5周期
C.第6周期
D.第7周期难度: 中等查看答案及解析
-
下列物质中,有固定熔、沸点的是( )
A.天然气
B.石油
C.甲烷
D.汽油难度: 中等查看答案及解析
-
有关化学用语正确的是( )
A.乙烯的最简式C2H4
B.乙醇的结构简式C2H6O
C.四氯化碳的电子式
D.臭氧的分子式O3难度: 中等查看答案及解析
-
下列用途主要体现铝的物理性质的是( )
①家用铝锅 ②盛浓硝酸的容器 ③制导线 ④焊接钢轨 ⑤包装铝箔 ⑥炼钢的脱氧剂 ⑦做防锈油漆 ⑧做合金用作飞机制造业材料.
A.①②③④⑤⑥
B.①②⑥⑦⑧
C.①③⑤⑦⑧
D.②③④⑥⑦⑧难度: 中等查看答案及解析
-
金属晶体的形成是因为晶体中主要存在( )
A.金属离子之间的相互作用
B.金属原子之间的作用
C.金属离子与自由电子间的相互作用
D.金属原子与自由电子间的相互作用难度: 中等查看答案及解析
-
下列有关铁元素的叙述中正确的是( )
A.Fe(OH)2易被氧化生成Fe(OH)3,说明稳定性:Fe(OH)2<Fe(OH)3
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI→FeI3+3H2O
D.铁元素位于周期表的第五周期第VIII族难度: 中等查看答案及解析
-
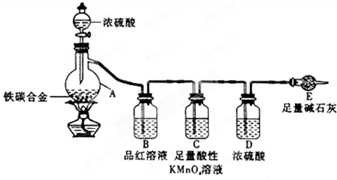
下列装置所示的实验不能达到目的是( )
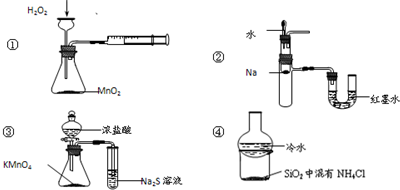
A.装置①定量测定化学反应速率
B.装置②验证Na和水反应放热
C.装置③比较KMnO4、Cl2、S的氧化性强弱
D.装置④加热烧杯,分离SiO2和NH4Cl难度: 中等查看答案及解析
-
某溶液中加入铝片有氢气产生,则该溶液中一定能大量共存的离子组是( )
A.Cl- NO3- Ba2+ Fe3+
B.SO42- S2- Al3+ Mg2+
C.Na+ K+ SO42- Cl-
D.NH4+ Ba2+ Cl- HCO3-难度: 中等查看答案及解析
-
下列实验操作会引起测定结果偏高的是( )
A.测定硫酸铜晶体结晶水含量的实验中,晶体加热完全失去结晶水后,将盛试样的坩埚放在实验桌上冷却
B.中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释
C.加热硫酸铜晶体时,温度过高或晶体溅出坩埚外
D.盛待测液的滴定管用水洗后,没用待测液润洗难度: 中等查看答案及解析
-
用0.01mol•L-1 H2SO4 和0.01mol•L-1NaOH溶液,中和后加水至100mL.若在滴定时终点有误差:①多滴了1滴H2SO4;②少滴了1滴H2SO4(1滴为0.05mL),则①和②两种情况下c(H+)之比的值是( )
A.10
B.50
C.5×103
D.104难度: 中等查看答案及解析
-
用铝热法从下列氧化物中还原出物质的量相同的金属所消耗的铝最少的是( )
A.Fe3O4
B.MnO2
C.V2O5
D.Cr2O3难度: 中等查看答案及解析
-
据报道,1995年化学家合成了一种分子式为C200H200的含多个碳碳叁键(-C≡C-)的链状烃,其分子中含碳碳叁键最多可以是( )
A.49个
B.50个
C.51个
D.100个难度: 中等查看答案及解析
-
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6).已知:C3H8(g)+5O2(g)-→3CO2(g)+4H2O(l)+2220.0kJ;C3H6(g)+4.5O2(g)-→3CO2(g)+3H2O(l)+2049kJ,下列说法正确的是( )
A.1molC3H8(g)与5molO2(g)反应生成3molCO2(g)和4molH2O(g)放出热量大于2220.0kJ
B.1molC3H6与4.5molO2反应生成3molCO2和3molH2O放出热量等于2049.0kJ
C.丙烷分子储存的能量大于丙烯分子
D.丙烷转化为丙烯的过程是一个吸热过程难度: 中等查看答案及解析
-
把少量金属钠投入到足量的氯化铝溶液中,下列叙述正确的是( )
A.析出金属铝
B.产生白色沉淀
C.产生红褐色沉淀
D.产生无色气体难度: 中等查看答案及解析
-
相关实验不能表达预期目的是( )
A.相关实验:把等质量的两份同种大理石块中的一份研成粉末,在同温度下分别与等体积同浓度的盐酸反应,观察放出气体快慢.
预期目的:验证接触面积对化学反应速率的影响
B.相关实验:把装有颜色相同的NO2与N2O4混合气体的小试管(密封)分别浸入热水和冷水中,观察试管中气体颜色变化.
预期目的:验证温度对化学平衡的影响
C.相关实验:直接将表面积相同的铝条和镁条投入同温度滴有酚酞的热水中,观察产生气泡的速率及溶液的颜色变化.
预期目的:比较同周期金属元素的金属性强弱
D.相关实验:将足量氯水分别滴入盛有溴化钠溶液和氯化钠溶液的试管中,观察溶液颜色变化.
预期目的:验证溴元素和碘元素的非金属性强弱难度: 中等查看答案及解析
-
美丽的“水立方”是北京奥运会游泳馆,其建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物.下列说法错误的是( )
A.四氟乙烯分子中既含有极性键又含有非极性键
B.ETFE分子中可能存在“-CH2-CH2-CF2-CF2-”的连接方式
C.ETFE在空气中易被氧化
D.ETFE是四氟乙烯和乙烯加聚反应的产物难度: 中等查看答案及解析
-
用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U型管的质量差,实验测得m(H):m(O)>1:8.下列对导致这一结果的原因的分析中,一定错误的是( )
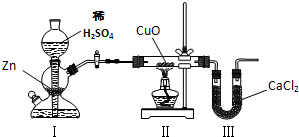
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中玻璃管内有水冷凝
D.CuO没有全部被还原难度: 中等查看答案及解析