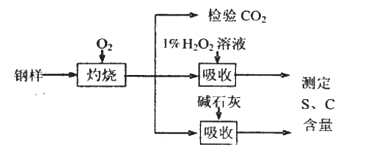
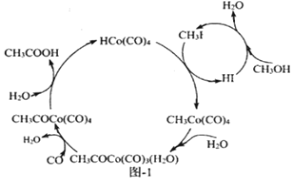
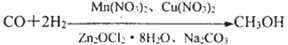-
2016年,我国科研团队开创了以煤为原料合成气态烯烃的新途径。下列说法错误的是
A. 煤的气化和液化是物理变化
B. 煤的干馏是在隔绝空气条件下进行的
C. 大量燃烧煤炭是造成雾霾的重要原因
D. 发展“煤制油”工程可减少对石油产品的依赖
难度: 简单查看答案及解析
-
下列物质的性质与用途具有对应关系的是
A. 二氧化硅熔点高,可用作光导纤维
B. 过氧化钠可与二氧化碳反应生成氧气,可用作呼吸供氧剂
C. 明矾易溶于水,可用作净水剂
D. 二氧化硫有氧化性,可用于漂白纸张
难度: 简单查看答案及解析
-
X、Y、Z、W、R是原了序数依次递增的短周期元素。X原子最外层电子数是其内层电子数的2倍,Y、R同主族,且两者核外电子数之和是X核外电子数的4倍,Z为短周期中金属性最强的元素,W是地売中含量最高的金属元素。下列叙述正确的是
A. Y、Z、W原子半径依次增大
B. X的最高价氧化物对应水化物的酸性比R的强
C. X、R分别与Y形成的常见化合物中化学键类型相同
D. 元素W、R的简单离子具有相同的电子层结构
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A. 铜跟稀HNO3反应:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
B. 向硫酸铝溶液中加入过量氨水:Al3++3OH-= AlO2-+2H2O
C. 向Ag(NH3)2NO3溶液中加入盐酸:Ag(NH3)2++2H+=Ag++2NH4+
D. NaHSO4溶液和Ba(OH)2溶液混合后溶液呈中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
难度: 中等查看答案及解析
-
下列实验操作、现象与所得结论一致的是
选项
实验操作
现象
结论
A
向沸水中滴入几滴FeCl3饱和溶液,继续煮沸,并用激光笔照射
溶液变红褐色,出现
丁达尔效应
产生了 Fe(OH)3胶体
B
向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液
溶液变蓝
氧化性:Fe3+>I2
c
将溴乙烷和NaOH的乙醇溶液混合加热,产生气体通入酸性KMnO4溶液
酸性KMnO4溶液褪色
产生了乙烯
D
向滴有酚酞的Na2CO3溶液中,逐滴加入BaCl2溶液
溶液红色逐渐褪去
BaCl2溶液呈酸性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是
A. 0.1mol·L-1NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
B. 0.1mol·L-lNaOH溶液中通入SO2气体至pH=7:c(Na+)= c(HSO3-)+2 c(SO32-)+ c(H2SO3)
C. 等物质的量浓度的CH3COOH溶液与NaOH溶液等体积混合后所得pH=9的溶液:c(OH-)-c(CH3COOH)=c(H+)=l×10-9mol·L-1
D. 20 mL0.1mol·L-1CH3COONa溶液与10 mL 0.1mol ·L-1 HCl溶液混合得到的溶液:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
难度: 困难查看答案及解析
-
下列化学用语表示正确的是
A. 中子数为16的硫原子:
B. Cl-的结构示意图:
C. 甲酸甲酯的结构简式:HCOOCH3 D. 氢氧化钠的电子式:
难度: 中等查看答案及解析
-
实验室采用下列装置制取氨气,正确的是
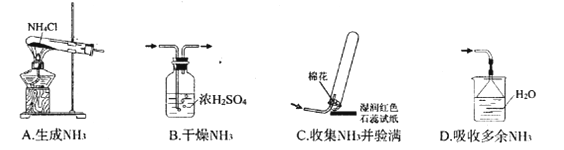
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是
A. pH=l 的溶液中:Ba2+、Fe3+ 、Cl-、SCN-
B. 能使酚酞变红的溶液:Ca2+、K+、HCO3-、CO32-
C.
=10-12的溶液中:NH4+、Cu2+、NO3-、SO42-
D. 由水电离的c(H+)=10-12mol·L-1的溶液中:Na+、Al3+、Cl-、NO3-
难度: 困难查看答案及解析
-
下列物质的转化在给定条件下能实现的是
A.
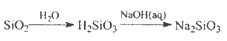
B.
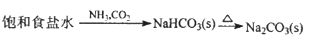
C.
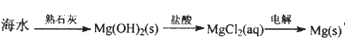
D.
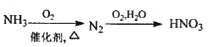
难度: 中等查看答案及解析
-
下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
难度: 中等查看答案及解析
-
用Cl2生产某些含氯有机物时会产生副产物HCl。利用如下反应,可实现氯的循环利用:
4HCl(g)+O2(g)
2Cl2(g)+2H2O(g) △H=-115.6 kJ·mol-1
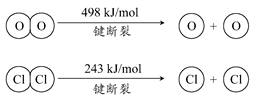
下列说法正确的是
A. 升高温度能提高HCl的转化率
B. 加入催化剂,能使该反应的焓变减小
C. 1molCl2转化为2molCl2原子放出243kJ热量
D. 断裂H2O(g)中1mol H-O键比断裂HCl(g)中1mol H-Cl键所需能量高
难度: 中等查看答案及解析
-
吗替麦考酚酯主要用于预防同种异体的器官排斥反应,其结构简式如下图所示。
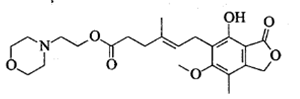
下列说法正确的是
A. 吗替麦考酚酯的分子式为C23H30O7N
B. 吗替麦考酚酯可发生加成、取代、消去反应
C. 吗替麦考酚酯分子中所有碳原子一定处于同一平面
D. 1mol吗替麦考酚酯与NaOH溶液充分反应最多消耗3mol NaOH反应
难度: 中等查看答案及解析
-
下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
难度: 困难查看答案及解析
-
—定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)
N2(g)+2CO2(g)各容器中起始物质的量浓度与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随间变化关系如下图所示。
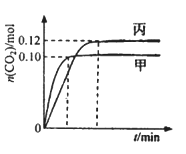
容器
温度/℃
起始物质的量浓度/mol·L-1
NO(g)
CO(g)
N2
CO2
甲
T1
0.10
0.10
0
0
乙
T1
0
0
0.10
0.20
丙
T2
0.10
0.10
0
0
下列说法正确的是
A. 该反应的正反应为吸热反应
B. 乙容器中反应达到平衡时,N2的转化率大于40%
C. 达到平衡时,乙容器中的压强一定大于甲容器的2倍
D. 丙容器中反应达到平衡后,再充入0.10mol NO和0.10mol CO2,此时v(正)<v(逆)
难度: 困难查看答案及解析
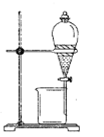
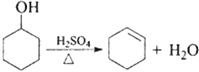

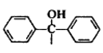 )
)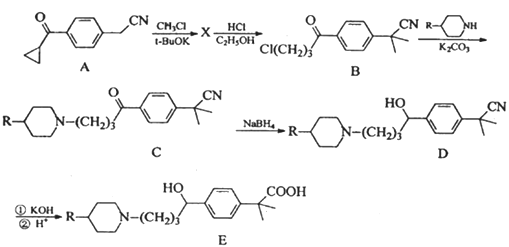
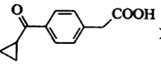 )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。 。化合物G(
。化合物G(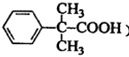 )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以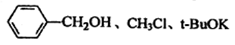 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______