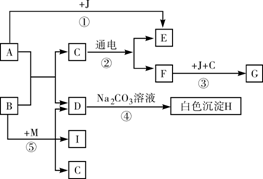
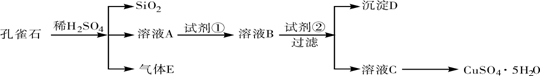
-
(5分)化学源于生活,请你根据学过的化学知识回答下列问题:
(1)在生活中,我们使用的化石燃料有煤、天然气和________。
(2)电线外面包了一层绝缘体,它的成分是聚氯乙烯它属于 ________材料。
(3)常用于净水作絮凝剂的是________(填名称)。
(4)“胃舒平”是一种胃药,其有效成分为Al(OH)3,其中铝(Al)是地壳中含量最________(填“高”或“低”)的金属元素,其金属活动性比铜的金属活动性________(填“强”或“弱”)
难度: 中等查看答案及解析
-
(6分,每空1分)
(1)目前,我国一些城市推广使用“乙醇汽油”作汽车燃料:
①乙醇属于________化合物(填“有机”或“无机”)。
②写出乙醇完全燃烧的化学方程式:。
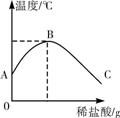
(2)将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出烧杯中溶液的温度,溶液温度随加入稀盐酸的质量而变化如右图所示:
①由图知,稀盐酸与氢氧化钠溶液发生的反应是________
(填“放热”或“吸热”)反应。
②从A到B过程中,烧杯中溶液的pH逐渐________。
B点表示的含义是________。
(3)小明家菜地里的蔬菜叶子发黄了,妈妈叫他去买化肥碳酸氢铵(NH4HCO3)来施用,当他到化肥商店时,碳酸氢铵刚好缺货,你建议他买 ________ (填“尿素”或“氯化钾”),也能起到与碳酸氢铵相同的作用。
难度: 中等查看答案及解析
-
(4分) 下表是KNO3在不同温度时的溶解度,请回答下列问题。

(1)分析表中数据,归纳出KNO3的溶解度随温度变化的规律________。
(2)20℃时,在装有5g KNO3晶体的试管中,加入10g水并充分振荡,此时所得溶液为 (选填“饱和”或“不饱和”)溶液。再将该试管放入盛有热水的烧杯中,使试管内溶液温度升至60℃,此时试管内的溶液中溶质与溶剂的质量比为________。
(3)配制一定溶质质量分数的KNO3溶液时,溶解过程所需要的仪器有________。
难度: 中等查看答案及解析
-
(4分) 下图中的几种物质是常见的盐,请回答下列问题。
(1)在碳酸钠溶液中滴入氯化钙溶液,现象是________。
(2)碳酸钙、碳酸钠均能与稀盐酸反应生成CO2,是因为碳酸钙、碳酸钠中均含有________(写离子符号)。
(3)硫酸铜溶液与氢氧化钠溶液能发生反应,该反应的化学方程式为 ;硫酸铜溶液与氯化钠溶液不能反应,其理由是________。
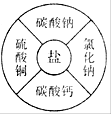
难度: 中等查看答案及解析