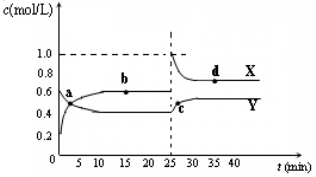
-
在已经处于化学平衡状态的体系中,如果下列量发生变化,其中一定能表明化学平衡移动的是
A.反应混合物的浓度 B.反应体系的压强
C.正、逆反应的速率 D.反应物的转化率
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.化学反应除了生成新的物质外,只伴随着热量的变化
B.物质燃烧不一定是放热反应,放热的化学反应不需要加热就能发生
C.太阳能、氢能、生物质能属于新能源
D.化石燃料是一次能源,乙醇是不可再生能源
难度: 中等查看答案及解析
-
Se是人体必需微量元素,下列关于
说法正确的是( )
A.
互为同素异形体
B.
互为同位素
C.
物理性质和化学性质均相同
D.
都含有34个中子
难度: 中等查看答案及解析
-
元素符号、反应方程式、结构示意图、电子式、结构式等通常叫做化学用语。下列有关化学用语的表示方法中正确的是( )
A.硫原子的原子结构示意图:
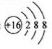
B.NH4Cl的电子式:
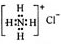
C.原子核内有10个中子的氧原子:
D.用电子式表示氯化氢分子的形成过程:
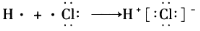
难度: 中等查看答案及解析
-
反应2A(g)
2B(g)+C(g) △H>0,达到平衡时,要使逆反应速率降低,A的浓度增大,应采取的措施是( )
A.减压 B.降温 C.加压 D.增大B的浓度
难度: 中等查看答案及解析
-
下列说法中错误的是( )
A.有气体参加的化学反应,增大压强,可使单位体积内活化分子百分数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活
化分子之间发生的碰撞不一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数增加,从而加快化学反应速率
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中,当下列哪些物理量不再发生变化时,表明下述反应:A(s)+2B(g)
C(g)+D(g)已达到平衡状态( )
①混合气体的压强 ②混合气体的质量 ③各气体物质的物质的量浓度
④气体的总物质的量⑤混合气体的平均相对分子质量
A.②③⑤ B.①②③ C.②③④⑤ D.①③④⑤
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A.已知2SO2(g)+O2
2SO3(g) 为放热反应,则SO2的能量一定高于SO3的能量
B.已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定
C.已知H+(aq)+OH-(aq)=H2O(1)△H=﹣57.3kJ/mol,则任何酸碱中和的反应热均为57.3 kJ
D.已知2C(s)+2O2 (g)═2 CO2(g)△H1 2C(s)+O2 (g)═2 CO (g)△H2 则△H1<△H2
难度: 中等查看答案及解析
-
A、B、C、D四种原子序数依次增大的元素,分布在三个不同的短周期,其中B与C为同一周期的相邻元素,A与D为同一主族。C原子的最外层电子数是次外层电子数的3倍,D是所在周期原子半径最大的元素。下列说法正确的是( )
A.离子半径:D>C>B
B.B的氢化物比C的氢化物更稳定
C.C与D可形成化合物D2C2,1mol该物质与水完全反应转移的电子数为NA
D.由A、B、C形成的化合物一定只有共价键没有离子键
难度: 中等查看答案及解析
-
下列有关热化学方程式及其叙述正确的是 ( )
A.氢气的燃烧热(△H)为-285.5kJ/mo1,则水电解的热化学方程式为:
2H2O(1) =2H2(g)+O2(g) △H=+285.5KJ/mo1
B.1mol甲烷完全燃烧生成CO2和H2O(1)时放出890kJ热量,它的热化学方程式为
1/2CH4(g)+O2(g)= 1/2CO2(g)+H2O(1) △H=-445kJ/mol
C.已知2C(s)+O2(g)=2CO(g) △H=-221kJ·mol-1,则C的燃烧热(△H)为-110.5kJ/mo1
D.HF与NaOH溶液反应:H+(aq)+OH-(aq)=H2O(1) △H= -57.3kJ/mol
难度: 中等查看答案及解析
-
短周期元素X、Y的原子序数相差2,下列叙述正确的是( )
A.X与Y不可能位于同一周期
B.X与Y不可能形成原子个数比为1:1型离子化合物
C.X离子与Y离子电子层结构可以相同,也可以不同
D.X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构
难度: 中等查看答案及解析
-
一定条件下,化学反应2H2+O2===2H2O的能量变化如图所示,则反应的热化学方程式可表示为( )

A.H2(g)+1/2O2(g)===H2O(g) ΔH=(a+b) kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=2(b-a) kJ·mol-1
C.H2(g)+1/2O2(g)===H2O(l) ΔH=(b+c-a) kJ·mol-1
D.2H2(g)+O2(g)===2H2O(l) ΔH=2(a-b-c) kJ·mol-1
难度: 中等查看答案及解析
-
对可逆反应2A(s)+3B(g)
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③缩小反应容器容积压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
难度: 中等查看答案及解析
-
下列变化不能用勒夏特列原理解释的是( )
A.工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B.工业合成氨的反应,往往需要使用催化剂
C.Fe(SCN)3溶液中加入少量固体KSCN后颜色变深
D.实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
已知碳、一氧化碳、晶体硅的燃烧热分别是△H =-393.5kJ/mol、△H =-283 kJ/mol和△H =-989 kJ/mol,则工业冶炼晶体硅反应2C(s)+SiO2(s)= Si (s)+2 CO(g) 的反应热为( )
A.+768 kJ/mol B.-768 kJ/mol C.+2342 kJ/mol D.-2342 kJ/mol
难度: 中等查看答案及解析
-
已知:2H2(g)+O2(g)=2H2O(g) △H1
3H2(g)+Fe2O3(s)=2Fe(s)+3H2O(g) △H2
2 Fe(s)+3/2O2(g)=Fe2O3(s) △H3
2Al(s)+3/2O2(g)=Al2O3(s) △H4
2Al(s)+Fe2O3(s)=A12O3(s)+2Fe(s) △H5
下列关于上述反应焓变的判断正确的是( )
A.△H1<0,△H3>0 B.△H5<0,△H4 <△H3
C.△H1=△H2+△H3 D.△H3=△H4+△H5
难度: 中等查看答案及解析
-
将4 mol A气体和2 mol B气体在2 L的密闭容器中混合并在一定条件下发生如下反应2A(g)+B(g)
2C(g) ΔH<0,4 s后反应达到平衡状态,此时测得C的浓度为0.6mol/L,下列说法中正确的是( )
A.反应过程中,当A、B、C的物质的量浓度之比为2∶1∶2时,反应即达到平衡状态
B.4 s内用物质B表示的反应速率为0.075 mol/(L·s)
C.达平衡后若增大压强,A的转化率降低
D.达平衡后若升高温度,C的浓度将增大
难度: 中等查看答案及解析
-
某化学研究小组探究外界条件对化学反应mA(g)+nB(g)
pC(g)的速率和平衡的影响图像如下,下列判断正确的是( )
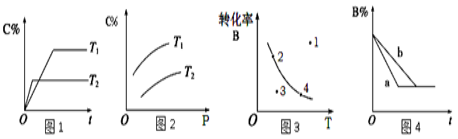
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n﹤p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
难度: 中等查看答案及解析
-
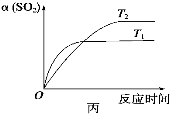
已知反应:2SO2(g)+O2(g)
2SO3(g) ΔH<0。某温度下,将2 mol SO2和1 mol O2置于10 L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
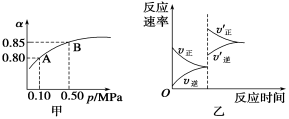
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
难度: 中等查看答案及解析
-
一定温度下,C和H2O(g)在密闭容器中发生下列反应:①C(s)+H2O(g)
CO(g)+H2(g) ②CO(g)+H2O(g)
CO2(g)+H2(g)
当反应达到平衡时,测得c(H2)=1.9mol/L,c(CO)=0.1 mol/L,则CO2的浓度为( )
A.0.1 mol/L B.0.9 mol/L C.1.8 mol/L D.1.9mol/L
难度: 简单查看答案及解析