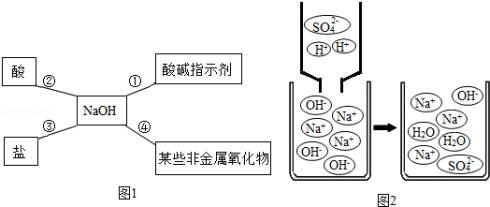
-
Na2CO3的水溶液呈碱性,下列说法错误的是( )
A.碳酸钠在水中会电离出OH﹣
B.往碳酸钠溶液中加稀硫酸后溶液的pH降低
C.碳酸钠溶液中存在OH﹣
D.往碳酸钠溶液中滴加紫色石蕊试液后溶液显蓝色
难度: 简单查看答案及解析
-
在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是( )
A.滴入适量FeCl3溶液,溶液变黄,但无沉淀生成
B.滴入几滴酚酞试液,酚酞试液不变色
C.测得反应后溶液中Na+与Cl﹣的个数比为1:1
D.滴入适量AgNO3溶液和稀硝酸,观察到有白色沉淀
难度: 中等查看答案及解析
-
如图所示的实验操作或装置正确的是( )

难度: 简单查看答案及解析
-
某同学的实验记录有如下数据,其中不合理的是( )
A.测得某溶液的pH为0
B.用烧杯量取9.3毫升硫硫酸铜溶液
C.用托盘天平称得3.2克红磷
D.某溶液溶质质量分数是6.45%
难度: 简单查看答案及解析
-
某同学从资料中获悉,一些紫色的叶或花瓣浸出液具有类似石蕊试液的性质.如果他想知道紫色喇叭花是否具有这种性质,应把花瓣浸出液分别滴入下列哪组物质进行观察( )
A.食醋,碱性肥皂水 B.食醋,酸奶
C.糖水,酸奶 D.食醋,食盐水
难度: 简单查看答案及解析
-
当你用复印机复印材料时,经常能闻到一股特殊的气味,这就是臭氧(O3)的气味.氧气在放电条件下可以转化为臭氧.下列与此相关的说法正确的是( )
A.氧气变成臭氧的过程是物理变化
B.氧气与臭氧互为同位素
C.臭氧分子由一个氧分子和一个氧原子构成
D.氧气、臭氧是两种不同单质
难度: 简单查看答案及解析
-
“NaCl+CO2+NH3+H2O═NaHCO3+NH4Cl”是著名的“侯氏制碱法”的重要反应,反应生成的(一种盐)达到一定浓度时会从溶液中先结晶出来,下面是4位同学对该反应涉及的有关知识发表的部分见解,其中正确的是( )
A.这个反应属于复分解反应
B.NaHCO3一定是难溶于水的物质
C.反应后的溶液中存在NH4+
D.结晶出NaHCO3后的溶液中没有Na+
难度: 简单查看答案及解析
-
鱼苗在长途运输中,通常将鱼苗养在相对密闭的容器内,加入某种药品,使容器内满足下列条件才能保持鱼苗的存活:充足的氧气、及时除去鱼苗呼出的CO2水的pH调节在8左右,碱性不能太强.现有以下四种物质供选择:双氧水、过氧化钙(CaO2).过氧化钠(Na2O2)、氯酸钾.它们的有关化学性质如下:
(1)2H2O2
2H2O+O2↑
(2)2Na2O2+2H20═4NaOH十O2↑
(3)2Na2O2+2CO2═2Na2CO3+O2
(4)2CaO2+2H2O═2Ca(OH)2+O2↑
(5)2CaO2+2CO2═2CaCO3↓+O2
(6)KClO3不与H2O,CO2反应
在鱼苗长途运输中你认为最适合加入的物质是( )
A.双氧水 B.过氧化钙 C.过氧化钠 D.氯酸钾
难度: 简单查看答案及解析
-
一定质量的氢氧化钡溶液中逐渐加入碳酸钠粉末(不考虑溶液体积变化),直至过量.如图横坐表示加入碳酸钠粉末的质量,根据图象判断,纵坐标可能表示( )
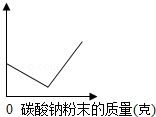
A.生成沉淀的质量 B.溶液中溶剂的质量
C.溶液中溶质的质量 D.溶液的pH
难度: 中等查看答案及解析
-
某一溶液由盐酸、碳酸钠、稀硫酸、氯化铜、氯化钠中的一种或几种混合而成.现向该混合溶液中滴入氢氧化钡溶液,产生的沉淀质量与加入氢氧化钡溶液体积如图所示,则下列判断正确的是( )
A.该溶液中含有硫酸或盐酸,也可能两种酸同时含有
B.该溶液中不可能含碳酸钠
C.该溶液是否含氯化铜不能确定
D.该溶液的组成只可能有一种情况
难度: 中等查看答案及解析
-
下列图象能正确反应其对应操作中各量变化关系的( )
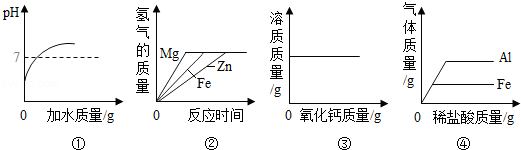
A.①向稀盐酸中不断加水
B.②等质量的稀硫酸分别与足量的镁、铁、锌三种金属反应
C.③向一定温度下的饱和氢氧化钙溶液中加入氧化钙固体
D.④分别向等质量的铝和铁中加入溶质质量分数相同的稀盐酸至过量
难度: 中等查看答案及解析