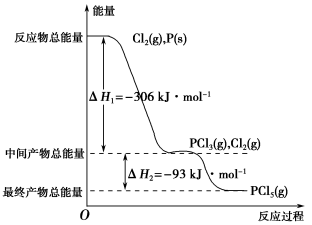
-
绿色能源是指使用过程中不排放或排放极少污染物的能源,如一级能源中的水能、地热、天然气等;二级能源中电能、氢能等。下列能源属于绿色能源的是
①太阳能 ②风能 ③石油 ④煤 ⑤潮汐能 ⑥木材
A.①②③ B.③④⑤ C.④⑤⑥ D.①②⑤
难度: 中等查看答案及解析
-
热化学反应方程式中物质前的化学计量数表示
A.分子数 B.原子个数 C.物质的量 D.物质的质量
难度: 简单查看答案及解析
-
下列对
H2(g)+
I2(g)===HI(g)ΔH=+26 kJ·mol-1的叙述中,正确的是
A.1 mol氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量
B.1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量
C.1 mol H2(g)与1 mol I2(g)完全反应生成2 mol的HI气体需吸收52 kJ的热量
D.1 mol H2(g)与1 mol I2(g)完全反应放出26 kJ的热量
难度: 中等查看答案及解析
-
下列热化学方程式正确的是
A.2SO2+O2
2SO3 ΔH=-196.6 kJ·mol-1
B.C(g)+O2(g)===CO(g)ΔH=+393.5 kJ·mol-1
C.H2(g)+
O2(g)===H2O(g) ΔH=-241.8 kJ
D.2H2(g)+O2(g)===2H2O(l)ΔH=-571.6 kJ·mol-1
难度: 简单查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是
A.铝片与稀硫酸反应 B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的炭与CO2反应 D.甲烷在O2中的燃烧
难度: 中等查看答案及解析
-
已知H—H键能为436 kJ·mol-1,H—N键能为391 kJ·mol-1,根据化学方程式:
N2+3H2
2NH3 ΔH=-92.4 kJ·mol-1,则N≡N键的键能是
A.431 kJ·mol-1 B.946 kJ·mol-1
C.649 kJ·mol-1 D.869 kJ·mol-1
难度: 中等查看答案及解析
-
已知空气-锌电池的电极反应为:
锌粒:Zn + 2OHˉ— 2eˉ= ZnO + H2O
石墨:O2 + H2 + 2eˉ = 2OHˉ。
根据判断,锌片
A.正极,并被还原 B.正极,并被氧化
C.负极,并被还原 D.负极,并被氧化
难度: 中等查看答案及解析
-
用石墨电极电解CuCl2和KCl混合溶液,电解初期阴极和阳极分别析出的物质是
A.H2、Cl2 B.Cu、Cl2 C.H2、O2 D.Cu、O2
难度: 中等查看答案及解析
-
下列事实中,与电化学腐蚀无关的是
A.镀锡的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
B.为保护海轮的船壳,常在船壳上镶入锌块
C.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更易被腐蚀
D.在空气中,光亮的银表面逐渐变暗
难度: 中等查看答案及解析
-
关于下图所示的原电池,下列说法正确的是
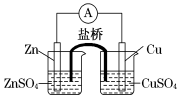
A.电子沿着盐桥从锌电极流向铜电极
B.盐桥中的阳离子向硫酸铜溶液中迁移
C.电流从锌电极通过电流计流向铜电极
D.铜电极上发生的电极反应是2H++2e-===H2↑
难度: 中等查看答案及解析
-
今有如下三个热化学方程式:
H2(g)+
O 2(g)=H2O(g) ΔH=a kJ·mol-1;
H2(g)+
O 2(g)=H2O(l) ΔH=b kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=c kJ·mol-1。
关于它们的下列表述正确的是
A.三个都是吸热反应 B.a、b、c均为正值
C.a=b D.2b=c
难度: 中等查看答案及解析
-
下列用来表示物质变化的化学用语中,正确的是
A.氢氧燃料电池在碱性介质中的负极反应式:O2+2H2O+4e一=4OH-
B.电解饱和食盐水时,阳极的电极反应式为:2C1-一2e一 =C12↑
C.粗铜精炼时,与电源正极相连的是纯铜,电极主要反应式为:Cu一2e-=Cu2+
D.钢铁发生电化学腐蚀的负极反应式:Fe一3e—=Fe3+
难度: 中等查看答案及解析
-
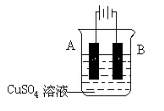
如图所示,电流计的指针发生偏转,正极变粗,负极变细,符合这种情况的是
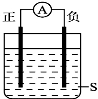
A.正极Cu,负极Zn,S为稀H2SO4
B.正极Zn,负极Cu,S为CuSO4溶液
C.正极Ag,负极Zn,S为AgNO3溶液
D.正极Fe,负极Cu,S为AgNO3溶液
难度: 中等查看答案及解析
-
电瓶车所用电池一般为铅蓄电池(如图),这是一种典型的可充电电池,电池总反应式为: Pb+PbO2+2H2 SO4
2Pb SO4+2H2O。则下列说法正确的是
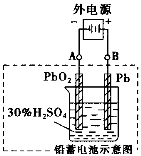
A.放电时,负极板上发生了还原反应
B.放电时,正极反应是:Pb一2e一+ SO42—=PbSO4
C.充电时,铅蓄电池的负极应与充电器电源的正极相连
D.充电时,阳极反应是:PbSO4一2e一+2H2O= PbO2+ SO42—+4H+
难度: 中等查看答案及解析
-
已知①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+
O2(g)===H2O(l) ΔH3=-285.8 kJ/mol
则2C(s)+2H2(g)+O2(g)===CH3COOH(l)的反应热为
A.-870.3 kJ/mol B.-571.6 kJ/mol
C.+787.0 kJ/mol D.-488.3 kJ/mol
难度: 中等查看答案及解析
-
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+。
则A、B、D、E金属性由强到弱的顺序为
A.A>B>E>D B.A>B>D>E C.D>E>A>B D.D>A>B>E
难度: 中等查看答案及解析
-
某大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 ===2CO2 +3H2O,电池示意如图,下列说法不正确的是
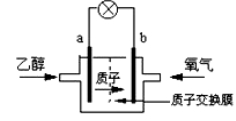
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:O2 + 4e-+ 4H+ =2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
难度: 中等查看答案及解析
-
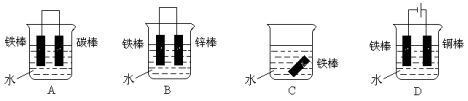
某学生欲完成2HCl+2Ag===2AgCl↓+H2↑反应,设计了下列四个实验,你认为可行的实验是

难度: 中等查看答案及解析
-
用惰性电极实现电解,下列说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物质的量之比为1∶1
难度: 中等查看答案及解析
-
用铂电极电解100mL H2SO4 与CuSO4 的混合液,通电一段时间后,两极均收集到2.24L气体(标准状况),则原混合液中Cu2+的物质的量浓度为
A.1mol·L-1 B.2 mol·L-1 C.2.5 mol·L-1 D.3 mol·L-1
难度: 中等查看答案及解析