-
19世纪门捷列夫的突出贡献是 ( )
A.提出了原子学说 B.提出了分子学说
C.发现了稀有气体 D.发现了元素周期律
难度: 简单查看答案及解析
-
在元素周期表中,第三、四、五、六周期元素的数目分别是 ( )
A.8、8、18、32 B.8、18、18、32
C.8、18、18、18 D.8、8、18、18
难度: 简单查看答案及解析
-
在短周期元素中,原子的核电荷数、核外电子层数,每层所容纳的电子数、主族序数均为偶数的有( )
A.2种 B.3种 C.4种 D.8种
难度: 简单查看答案及解析
-
短周期元素X的最高价氧化物的化学式为XO3,X处于元素周期表中 ( )
A.第2周期第ⅡA族 B.第2周期第ⅢA族
C.第3周期ⅣA族 D.第3周期ⅥA族
难度: 简单查看答案及解析
-
下列各组物质中,化学键类型不同的是( )
A.NaCl和CaO B.H2O和NH3 C.CaF2和CsCl D.CCl4和Na2O
难度: 简单查看答案及解析
-
同族元素所形成的同一类型的化合物,其结构和性质往往相似。化合物PH4I是一种白色晶体,下列对它的描述中正确的是( )
A.它是一种共价化合物 B.它受热时,可能会分解产生有色气体
C.这种化合物不能跟碱反应 D.它只含共价键,不含离子键
难度: 简单查看答案及解析
-
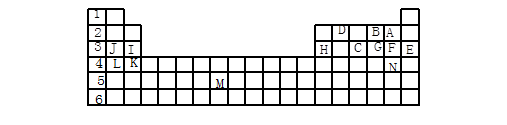
短周期元素A、B、C的位置如图所示,已知B、C两元素所在族序数之和是A元素所在族序数的二倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C依次是( )
A
B
C
A.Be、Na、Al B.B、Mg、Si C.O、 P、 Cl D.C、Al、 P
难度: 简单查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.元素Y、Z、W具有相同电子层的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY> XmR
D.由X、Y、Z三种元素形成的化合物包含离子键和非极性共价键
难度: 简单查看答案及解析
-
Na+、F-、Ne可以归为一类,与它们同类的粒子组是( )
A.H2O、OH- B.K+、H3O+
C.NH、NH3·H2O D.OH-、H2O2
难度: 简单查看答案及解析
-
“神舟七号”所用动力燃料之一为氢化锂“三兄弟”——LiH、LiD、LiT.有关下列叙述中正确的是 ( )
A.三种物质质子数之比为1∶2∶3 B.三种物质中子数之比为1∶1∶1
C.三种物质的摩尔质量之比为8∶9∶10 D.三种物质的化学性质不相同
难度: 简单查看答案及解析
-
X、Y是元素周期表ⅦA族中的两种元素.下列叙述中能说明X的非金属性比Y强的是 ( )
A.X原子的电子层数比Y原子的电子层数多
B.X的氢化物的沸点比Y的氢化物的沸点低
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
难度: 简单查看答案及解析
-
下列关于元素周期表和元素周期律的说法不正确的是 ( )
A.从氟到碘,生成的氢化物熔、沸点逐渐升高,稳定性逐渐减弱
B.因为钠原子比铝原子容易失去电子,所以钠比铝的还原性强
C.从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强
D.氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的氧化性强
难度: 简单查看答案及解析
-
将少量氯水加入KI溶液中振荡,再加入CCl4振荡,静置观察到的现象是 ( )
A.形成均匀的紫红色溶液 B.有紫色沉淀析出
C.液体分层,上层呈紫红色 D.液体分层,下层呈紫红色
难度: 简单查看答案及解析
-
.下列粒子中,电子数大于质子数且质子数大于中子数的是 ( )
A.D2O B.Li+ C.OD- D.OH-
难度: 简单查看答案及解析
-
下列各组化合物的性质比较,不正确的是 ( )
A.酸性: HClO4 > HBrO4 > HIO4 B.碱性: NaOH > Mg(OH)2 > Al(OH)3
C.稳定性: PH3 > H2S > HCl D.非金属性:F > O > S
难度: 简单查看答案及解析
-
X、Y两元素是同周期的非金属元素,如果X 原子半径比Y的大,下面说法正确的是 ( )
A.最高价氧化物对应的水化物的酸性,X的比Y的强
B.X的非金属性比Y的强
C.X的阴离子比Y的阴离子还原性强
D.X的气态氢化物比Y的稳定
难度: 简单查看答案及解析
-
根据元素周期表和元素周期律分析下面的推断,其中错误的是 ( )
A.铍(Be)的原子失电子能力比镁弱
B.砹(At)的氢化物不稳定
C.硒(Se)化氢比硫化氢稳定
D.氢氧化锶[Sr(OH)2]比氢氧化钙的碱性强
难度: 简单查看答案及解析
-
某元素X的气态氢化物的化学式为H2X,则X的最高价氧化物的水化物的化学式为 ( )
A.H2XO3 B.HXO3 C.H3XO4 D.H2XO4
难度: 简单查看答案及解析
-
下列关于F、Cl、Br、I性质的比较,不正确的是 ( )
A.它们的原子核外电子层数随核电荷数的增加而增多
B.被其他卤素单质从其卤化物中置换出来的可能性随核电荷数的增加而增大
C.它们的氢化物的稳定性随核电荷数的增加而增强
D.单质的颜色随核电荷数的增加而加深
难度: 简单查看答案及解析
-
酸根RO3-所含电子数比硝酸根离子(NO3-)的电子数多10,下列说法中正确的是( )
A.R是第三周期元素
B.RO3-和NO3-均只能被还原,不能被氧化
C.R元素的最高正价与N元素最高正价相同
D.R和N两元素的单质都是空气的主要成分
难度: 简单查看答案及解析
-
两种短周期元素X和Y可组成化合物XY3,在Y的原子序数为m时,X的原子序数为:① m-4 ② m+4 ③ m+8 ④ m-2 ⑤ m+6,其中正确的组合的是 ( )
A.①②④ B.①②③④⑤ C.①②③⑤ D.①②⑤
难度: 简单查看答案及解析
-
X、Y、Z都是短周期元素,X原子的最外层只有1个电子,Y原子的M层电子数只有K层与L层电子数之和的一半,Z原子的L层电子数比Y原子的L层电子数少2,且Y元素可有3种正价,三种正价的差值都是2。由X、Y、Z三种元素组成的化合物的化学式可能是 ( )
①X2YZ3 ②XYZ3 ③XYZ4 ④X2YZ4 ⑤X3YZ3 ⑥X3YZ4
A.①②③ B.④⑤⑥ C.②⑤⑥ D.①③⑤
难度: 简单查看答案及解析
-
用20.0mL,0.100mol/L的含氧酸HnRO4溶液与15.0mL,0.200mol/L的某M(OH)m溶液恰好完全反应全部生成正盐,则用m来表示的R的化合价是( )
A.+(8-2m/3) B.+(8-2m)
C.+(8-3m/2) D.+(8-3m)
难度: 简单查看答案及解析
-
下列各组微粒中,半径依次增大的是 ( )
A.Al3+、Al、Mg、K B.S、Cl、Cl-、S2-
C.Na+、Na、Cl、Cl- D.Ca2+、K+、S2-、Cl-
难度: 简单查看答案及解析
-
下列关于化学键的说法正确的是( )
A.构成单质分子的微粒一定含有共价键
B.全部由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子中
D.不同元素组成的多原子分子里的化学键一定都是极性键
难度: 简单查看答案及解析
-
已知A、B、C、D的原子序数都不超过18,它们的离子aA(n+1)+、bBn+、cC(n+1)-、dDn-均具有相同的电子层结构,则下列叙述正确的是( )
A.原子序数:a > b > c > d
B.离子半径:A(n+1)+ > Bn+> C(n+1)- > Dn-
C.离子还原性:A(n+1)+ > Bn+,离子氧化性:C(n+1)- > Dn-
D单质还原性:B > A,单质氧化性:D > C
难度: 简单查看答案及解析
-
“铱星”计划中的铱的一种同位素是
,其核内中子数与质子数之差是 ( )
A.77 B.114 C.191 D.37
难度: 简单查看答案及解析
-
下列物质的电子式书写正确的是 ( )

难度: 简单查看答案及解析
-
元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构。下列推测不正确的是( )
A.同周期元素中X的金属性最强 B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
难度: 简单查看答案及解析
-
下列各图曲线分别表示物质的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),下列选项中的对应关系错误的是 ( )

A.图①可以表示F-、Na+、Mg2+、Al3+四种离子的离子半径大小关系
B.图②可以表示ⅡA族元素的最外层电子数
C.图③可以表示ⅥA族元素氢化物的沸点高低关系
D.图④可以表示第三周期元素的原子半径大小关系
难度: 简单查看答案及解析