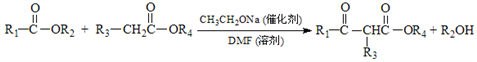
-
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,11.2L H2和D2的混合气体中所含的质子数为NA
B. 向足量水中通入1mol氯气,反应中转移的电子数为NA
C. 28g乙烯和丙烯的混合物中所含碳碳双键的数目为NA
D. 1L0.5mol·L-1Na2CO3溶液中阴离子的总数为0.5NA
难度: 中等查看答案及解析
-
化学与生活、生产息息相关,下列说法正确的是( )
A. 误服Al3+、Cu2+、Hg2+等重金属离子会使蛋白质变性而中毒
B. 家庭装修材料中散发出来的甲醛会严重污染居室环境
C. 冬季燃烧煤炭供热取暖与雾霾天气的形成没有必然联系
D. 镁、铝的氧化物和氢氧化物都是优质的耐高温材料
难度: 简单查看答案及解析
-
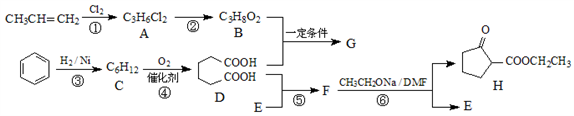
下图是几种常见有机物之间的转化关系,有关说法正确的是( )

A. 有机物a只能是淀粉
B. 反应①、②、③均为取代反应
C. 有机物c可以使酸性高锰酸钾溶液褪色
D. 有机物d的羧酸类同分异构体只有1种
难度: 中等查看答案及解析
-
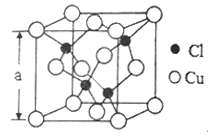
A、B、 C、D是原子序数依次增大的五种短周期主族元素。B、C、E最外层电子数之和为11;A 原子核外最外层电子数是次外层的2倍;C是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备D的单质;E单质是制备太阳能电池的重要材料。下列说法正确的是( )
A. 简单离子半径:B>C
B. 最高价氧化物对应水化物的酸性: A<E
C. 工业上不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 相同质量的C和D单质分别与足量稀盐酸反应,前者生成的氢气多
难度: 中等查看答案及解析
-
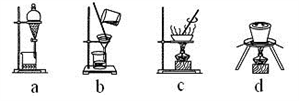
下列实验能达到实验目的且符合实验设计要求的是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
直接氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图,该电池的总反应为NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是( )

A. 左侧电极发生还原反应
B. 电池工作时,H+通过质子交换膜向负极移动
C. 正极的电极反应式为2H++2e-=H2↑
D. 消耗3.1g氨硼烷,理论上转移0.6mol电子
难度: 中等查看答案及解析
-
常温下,等体积 、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )
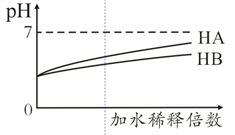
A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)> c(A-)> c(H+) > c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
难度: 中等查看答案及解析