-
把一块Al、Fe合金放入足量盐酸中,通入足量的Cl2,再加过量NaOH 溶液、过滤,把滤渣充分灼烧,得到固体残留物恰好与原合金质量相等,则合金中Fe、Al质量比为( )
A.1:1
B.3:1
C.1:4
D.7:3难度: 中等查看答案及解析
-
下列关于纯净物、混合物、强电解质、电解质和非电解质的组合正确的是( )
纯净物 混合物 强电解质 弱电解质 非电解质 ① 青铜 水煤气 硫酸 醋酸 干冰 ② 铁红 盐酸 硫酸钡 亚硫酸 二氧化硫 ③ 胆矾 碘酒 苛性钾 氢硫酸 碳酸钙 ④ 明矾 漂白粉 氯化钠 次氯酸 氯气
A.①
B.②
C.③
D.④难度: 中等查看答案及解析
-
下叙述正确的是( )
A.金属与盐溶液的反应都是置换反应
B.阴离子都只有还原性
C.与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物
D.国庆60周年放的烟花是某些金属元素焰色反应所呈现出来的色彩难度: 中等查看答案及解析
-
“纳米材料”是当代材料科学的前沿,其研究成果广泛应用于催化剂、军事科学及高新技术中.“纳米材料”是直径为几纳米至几十纳米的材料(1纳米为10-9m),若将纳米碳分子分散到水中,所形成的分散系具有的性质是( )
①能全部透过半透膜②能全部透过滤纸③形成黑色浊液④形成无色透明溶液⑤具有丁达尔效应.
A.①④
B.②⑤
C.只有③
D.只有④难度: 中等查看答案及解析
-
下列实验操作中错误的是( )
A.蒸发操作时,当有大量晶体析出时,才能停止加热
B.蒸馏操作时,应使温度计水银球浸在液面之下
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒山
D.萃取操作时,应使溶质在带取剂中的溶解度远大于在水中的溶解度难度: 中等查看答案及解析
-
下列叙述正确的是( )
A.金属钠着火,可用水扑灭
B.明矶水解形成胶体能吸附水中悬浮物,可用水的净化
C.浓硫酸溅到皮肤上,立即用碳酸钠稀溶液冲洗
D.氢氧化钠浓溶液溅入眼中,应立即用大量水冲洗,再用稀盐酸冲洗难度: 中等查看答案及解析
-
标准状况下,在三个干燥的烧瓶中,一瓶装入干燥纯净的氨气,一瓶装入含一半空气的氯化氢,一瓶装入二氧化氮和氧气(体积比为4:1),然后分别以水作溶剂做喷泉实验.实验结束后三个烧瓶中所得溶液的物质的量浓度之比为( )
A.1:1:1
B.5:5:4
C.2:1:2
D.无法确定难度: 中等查看答案及解析
-
以下物质间的每步转化,存在不能通过一步反应实现的是( )
A.Na→Na2O2→Na2CO3→Na0H
B.Fe→FeCl2→Fe(OH)2→Fe(OH)3
C.Al→Al2O3→A1(OH)3→NaAlO
D.Si→SiO2→Na2SiO3→H2SiO3难度: 中等查看答案及解析
-
甲、乙两烧杯中各盛有100mL 3mol/L的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2,则加入铝粉的质量为( )
A.1.6g
B.3.6g
C.2.7g
D.5.4g难度: 中等查看答案及解析
-
在由Fe、FeO和Fe2O3组成的混合物中加入100mL 2mol/L的盐酸,恰好使混合物完全溶解,并放出448mL气体(标准状况),此时溶液中无Fe3+离子.则下列判断正确的( )
A.混合物里三种物质反应时消耗盐酸的物质的量之比为1:1:3
B.反应后所得溶液中的阳离子与阴离子的物质的量之比为1:3
C.混合物里,FeO的物质的量无法确定,但Fe比Fe2O3的物质的量多
D.混合物里,Fe2O3的物质的量无法确定,但Fe比FeO的物质的量多难度: 中等查看答案及解析
-
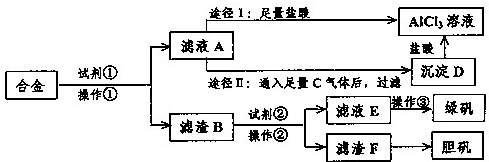
我国化学家侯德榜根据NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl都小的性质,运用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理制备纯碱.下面是在实验室进行模拟实验的生产流程示意图:
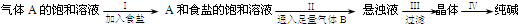
则下列叙述错误的是( )
A.A气体是NH3,B气体是CO2
B.把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C.纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶难度: 中等查看答案及解析
-
下列除去杂质的方法不正确的是( )
A.镁粉中混有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥
B.用过量氨水除去Fe3+溶液中的少量Al3+
C.用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水
D.Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量CO2后过滤难度: 中等查看答案及解析
-
将下列A~D四组物质wg分别在O2中充分燃烧后,再通过装有足昔Na2O2的干燥管,干燥管增重的质量一定为wg的是( )
A.C4H8O2
B.C6H12O6
C.C2H4O3
D.H2和CO的混合气体难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.标准状况下,分子数为NA的CO、C2H2混合气体体积为22.4L,质量为28g
B.7.8gNa2O2含有阴离子为0.2NA
C.14g乙烯和丙烯的混合气体中所含原子总数为3NA
D.5.6g铁与足量的氯气反应失去电子数为0.2NA难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是( )
A.无色溶液:Cu2+、H+、NO-3、HCO-3
B.能使pH试纸呈红色的溶液:Fe2+、NH+4、Cl-、NO-3
C.与铝反应放出氢气的溶液:K+、HCO-3、Br-、Ca2+
D.=0.1mol/L的溶液:Na+、K+、SiO2-3、NO-3
难度: 中等查看答案及解析
-
关于某溶液所含离子的检验方法和结论都正确的是( )
A.加入BaCl2溶液,有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液一定有SO42-
B.加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液中不一定有Cl-
C.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定有C032-或SO32-
D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定有NH4+难度: 中等查看答案及解析
-
将足量的CO2不断通入KOH、Ca(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为( )
A.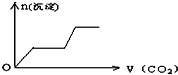
B.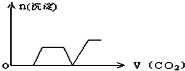
C.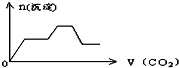
D.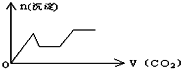
难度: 中等查看答案及解析
-
已知14mol/L的H2SO4溶液的溶质质量分数为80%,那么7mol/L的H2SO4溶液的溶质量分数将( )
A.大于40%
B.等于40%
C.小于40%
D.无法确定难度: 中等查看答案及解析
-
设KCl的摩尔质量为a g/mol,20℃时某KCl饱和溶液的物质的量浓度为b mol/L,该溶液的密度为ρg/cm3(ρ>1),下列说法不正确的是( )
A.20℃KCl的溶解度为100ab/(1000ρ-ab)g
B.KCl的质量分数为(ab/1000ρ)×100%
C.将此溶液蒸发部分水再恢复到20℃,溶液密度一定大于ρg/cm3
D.20℃密度小于ρg/cm3的KCl溶液是不饱和溶液难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
①小苏打溶液中加入少量的石灰水:Ca2++OH-+HCO-3=CaCO3↓+2H2O
②将金属钠加入水中:2Na+2H2O=2Na++2OH-+H2↑
③石灰石溶于醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O
④氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
⑤纯碱溶液中滴加少量盐酸:CO-23+H+=HCO-3
⑥次氯酸钙溶液中通入足量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO
⑦氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl-
⑧铜片插入三氯化铁溶液中:Cu+Fe3+=Cu2++Fe2+
⑨氯化铝溶液中滴加过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH+4.
A.①②⑤⑨
B.②③⑤⑨
C.④⑤⑥⑦
D.②③⑧⑨难度: 中等查看答案及解析
-
下列装置所示的实验中,能达到实验目的是( )
A.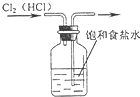
除去Cl2中的HCl杂质
B.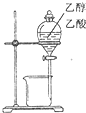
分离乙醇和乙酸
C.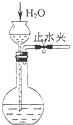
检查装置气密性
D.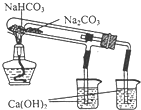
比较NaHCO3.Na2CO3对热稳定性难度: 中等查看答案及解析
-
有物质的量相等的短周期金属元素单质A和B,在A中加入足量盐酸,在B中加入足量稀硫酸,反应完全后,生成氢气的体积为V1和V2,且V1≠V2,若要确定生成物中A和B的化合价,至少还需要的数据是( )
A.V1:V2的值
B.V1和V2的值
C.A和B的物质的量
D.盐酸和稀硫酸的浓度难度: 中等查看答案及解析