-
化学与生活密切相关,下列有关说法正确的是
A.PM2.5是指大气中直径接近2.5微米的颗粒物,入肺影响健康。它具有丁达尔现象
B.纯净的二氧化硅是制备光导纤维的原料
C.漂白粉既可做漂白棉麻纸张的漂白剂,又可做游泳池及环境的消毒剂和净水剂;
D.合金材料的组成元素一定全部是金属元素
难度: 简单查看答案及解析
-
在下列条件的溶液中,各组离子一定能够大量共存的是
A.使酚酞试液变红的溶液:Na+、Cl-、SO42-、Fe3+
B.强酸性溶液中:Na+、K +、NO3-、SiO32-
C.可与Al反应放出氢气的溶液中:Na+、Ca2+、Cl-、HCO3-
D.使石蕊变蓝的溶液中:Ba2+、Na+、[Al(OH)4]-、Cl-
难度: 中等查看答案及解析
-
下列对物质的分类正确的是
A.烧碱、纯碱、熟石灰都是碱
B.Na2O、Al2O3、Fe2O3都是碱性氧化物
C.H2SO4、NaOH、NaNO3都是电解质
D.铝土矿、水玻璃、小苏打都是混合物
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.NaCl溶于水在电流作用下电离成Na+ 和Cl-
B.CaCO3在水中溶解度很小,但溶于水的CaCO3全部电离,所以CaCO3是强电解质
C.某元素在化学反应中由化合态变为游离态(单质),则该元素一定被氧化
D.化合反应一定是氧化还原反应
难度: 中等查看答案及解析
-
设NA表示阿伏加德罗常数,下列叙述中正确的是
A.标准状况下,2.24 L CCl4所含的原子数为0.5 NA
B.标准状况下0.5mol NO和0.5mol O2组成的混合气体的体积约为22.4L
C.78 g Na2O2 与足量水反应转移电子数为NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA
难度: 困难查看答案及解析
-
下列各组中两种物质在溶液中的反应,能用同一离子方程式表示的是
A.铁和稀盐酸、铁和稀硝酸 B.NaHCO3+ NaOH;NaHSO4+ NaOH
C.铜和浓硝酸、铜和稀硝酸 D.BaCl2+ H2SO4;Ba(OH)2+ Na2SO4
难度: 困难查看答案及解析
-
现有硫酸钠、氯化铵、氯化钠、硫酸铵四种无色溶液,只用一种试剂且各取一次将它们鉴别开来(可加热),这种试剂是
A.盐酸 B.碳酸钠溶液
C.氢氧化钡溶液 D.氢氧化钠溶液
难度: 中等查看答案及解析
-
已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色(淀粉遇I2变蓝)。下列判断正确的是
A.上述实验证明氧化性:MnO4->Cl2 > Fe3+ > I2
B.实验①生成的气体不能使湿润的淀粉KI试纸变蓝
C.上述实验中,共有两个氧化还原反应
D.实验②证明Fe2+既有氧化性又有还原性
难度: 困难查看答案及解析
-
对下列实验现象的解释正确的是
现 象
解 释
A
Na2O2 投入到 FeCl2 溶液中得到大量红褐色沉淀
Na2O2 具有还原性
B
浓硝酸在光照条件下变黄
浓硝酸不稳定,生成的有色产物能溶于浓硝酸
C
向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成
说明该溶液中含有SO42-
D
向盐酸中加入浓硫酸时产生白雾
说明浓硫酸具有脱水性
难度: 中等查看答案及解析
-
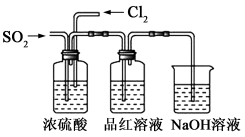
下列叙述正确的是
A.Na、Al、Fe金属单质在一定条件下与水反应都生成H2和对应的碱
B.漂白粉和明矾都常用于自来水的处理,二者的作用原理不相同
C.将SO2通入Ca(ClO)2溶液可生成CaSO3沉淀
D.过量的铜与浓硝酸反应,生成的气体只有NO2
难度: 中等查看答案及解析
-
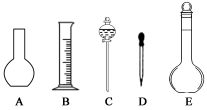
某课外实验小组设计的下列实验不合理的是

A.甲可用于制备并观察氢氧化亚铁沉淀
B.乙可用于证明过氧化钠与水反应放热
C.丙可用于制备并收集少量NO2气体
D.丁可用于实验室制备少量氨气
难度: 困难查看答案及解析
-
下列各组物质,能按下图(“→”表示反应一步完成)关系转化的是
选项
a
b
c
A
S
SO3
H2SO4
B
SiO2
Na2SiO3
H2SiO3
C
Na
Na2O
Na2CO3
D
Cu
CuO
Cu(OH)2
难度: 困难查看答案及解析
-
a g Fe2O3和Al2O3组成的混合物全部溶于20mL、物质的量浓度为0.05mol/L的硫酸中,反应后向所得溶液中加入10mLNaOH溶液,恰好使Fe3+、Al3+完全沉淀,则氢氧化钠溶液的物质的量浓度为
A.0.1mol/L B.0.2 mol/L
C.0.4mol/L D.0.8mol/L
难度: 困难查看答案及解析
-
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中可能含有的阳离子是
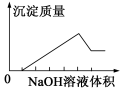
A.Mg2+、Al3+、Fe2+ B.H+、Mg2+、Al3+
C.H+、Ba2+、Al3+ D.只有Mg2+、Al3+
难度: 困难查看答案及解析
-
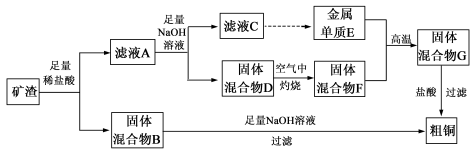
下列分离或提纯物质的方法正确的是
A.用渗析的方法精制Fe(OH)3胶体
B.用过滤的方法除去NaCl溶液中含有的少量淀粉胶体
C.用溶解、过滤的方法提纯含有少量BaSO4的BaCO3
D.用加热→蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质
难度: 中等查看答案及解析
-
下图所示是气体性质实验的常用装置,下列有关实验现象的说法不正确的是

A.若水槽中是水,试管中是NO2,可看到液面上升,若充入一定量的O2可使液体充满整个试管
B.若水槽中是NaOH溶液,试管中是Cl2,可看到液面上升、试管中黄绿色褪去
C.若水槽中是水并滴有几滴紫色石蕊,试管中是SO2,可看到液面上升并变为无色
D.若水槽中是水并滴有几滴酚酞,试管中是NH3,可看到液面上升并呈红色
难度: 困难查看答案及解析