-
化学已经渗透到人类生活的各个方面,下列说法不正确的是
A.户外钢架桥生锈主要是电化学腐蚀所致
B.葡萄中的花青素在碱性环境下显蓝色,故可用苏打粉检验假葡萄酒
C.导电塑料是应用于电子工业的一种新型有机高分子化合物
D.青岛世园会喷雾风扇依据化学能与热能转化原理,会自动喷出清凉水雾
难度: 中等查看答案及解析
-
X、Y、Z、W是短周期元素,X为地壳中含量最高的金属元素;Y原子最外层电子数是电子总数的2/3;Z的最高正化合价与最低负化合价的代数和为4;W原子在短周期中原子半径最大。下列说法正确的是
A.ZO3和水反应形成的化合物是离子化合物
B.粘在试管内壁上的Z可以用YZ2洗涤
C.最高价氧化物对应水化物的碱性:X>W
D.X位于金属与非金属的分界线处,常用来做半导体材料
难度: 中等查看答案及解析
-
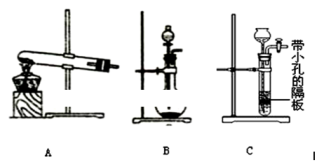
下列说法正确的是
A.滴定管在使用前要用待装液润洗,而容量瓶不用润洗
B.用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
C.检验红砖中的红色物质是否是Fe2O3的操作步骤为:样品→粉碎→加水溶解→过滤→向滤液中滴加KSCN溶液。
D.将CO2和SO2混合气体分别通入BaC12溶液、Ba(NO3)2溶液中,最终都有沉淀生成
难度: 中等查看答案及解析
-
下列关于有机物的叙述正确的是
A.甲苯分子中所有原子均在同一个平面上
B.乙烯使KMnO4溶液褪色,是因为两者发生了加成反应
C.分子式为C4H9Br的同分异构体共有4种(不考虑立体异构)
D.在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH
难度: 中等查看答案及解析
-
25℃时,已知弱酸的电离常数:K(CH3COOH) = 1.8 ×10-5;K1(H2CO3) = 4.4 ×10-7;K2(H2CO3) = 4.7 × 10-11;K(HClO) = 4.0 ×10-8。则下列说法正确的是
A.新制氯水与碳酸氢钠不反应
B.25℃时,0.1mol/L的醋酸溶液与0.01mol/L的醋酸溶液中,Ka前者小于后者
C.NaClO溶液中通入少量二氧化碳的反应为:2NaClO+CO2+ H2O = Na2CO3 +2HClO
D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH
pH(Na2CO3)>pH(NaClO)>pH(CH3COONa)
难度: 中等查看答案及解析
-
下列说法正确的是
A.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁
B.饱和FeCl3溶液在20℃时呈现棕黄色,100℃呈现红褐色,不能用平衡移动原理来解释
C.在c(H+)/c(OH-)= l012 溶液中 N a+、I-、NO3-、SO42-不能大量共存
D.在原电池装置中,电子从负极流出,沿导线流入正极,经溶液或盐桥回到负极
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符的是
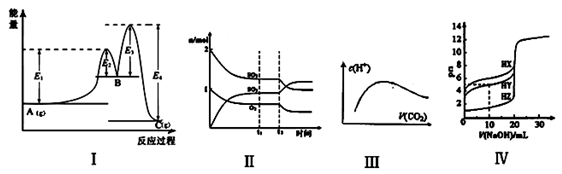
A.图Ⅰ中 可以看出反应A(g)=C(g)的△H=(E1-E4)kJ·mol-1
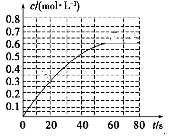
B.图Ⅱ表示一定条件下进行的反应2SO2+O2
2SO3 各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.图Ⅲ表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
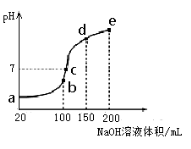
D.图Ⅳ曲线表示用0.1000mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
难度: 中等查看答案及解析