-
下列反应一定能自发进行的是( )
A、放热反应 B、熵增加的反应C、熵增加的吸热反应D、熵增加的放热反应
难度: 简单查看答案及解析
-
增大压强对下列反应的速率无影响的是( )
A.CO2(g)+Ca(OH)2=CaCO3↓+H2O
B.H2(g)+I2(g)
2HI (g)
C.NaCl(aq)+AgNO3(aq)=AgCl↓(s)+NaNO3 (aq)
D.N2(g)+3H2(g)
2NH3 (g)
难度: 简单查看答案及解析
-
在化学反应A(g)+3B(g)
2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
A.vA=vB B.vA=2vC C.3vB=vC D.vB=3vD
难度: 简单查看答案及解析
-
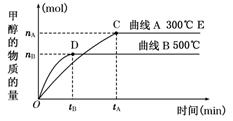
对气体反应:mA+nB
eC 温度(T)、压强(P)、时间(t)与生成物的体积百分数C%的关系图,下列结论正确的是( )
A. m+n>e B.m+n<e
C. 正反应是吸热反应 D. 逆反应是放热反应
难度: 简单查看答案及解析
-
pH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的pH>a,则该电解质可能是( )
A. AgNO3 B.NaOH C. H2SO4 D.Na2SO4
难度: 简单查看答案及解析
-
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能说明反应A(s)+2B(g)
C(g)+D(g)已达平衡状态的是
A.混合气体的压强 B.混合气体的密度
C.气体的平均相对分子质量 D.B的物质的量浓度
难度: 简单查看答案及解析
-
下列说法不正确的是
A.钢铁发生电化学腐蚀时,负极发生的反应是2H2O+O2+4e-= 4 OH-
B.在空气中,金属铝表面能迅速被氧化形成保护膜,因此铝不容易被腐蚀
C.铸铁输油管道应埋在干燥致密不透气的土壤中
D.白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化
难度: 简单查看答案及解析
-
化学平衡常数K的数值大小是衡量化学反应进行程度的标志,在常温下,下列反应的平衡常数的数值如下:
2NO(g)
N2(g)+O2(g) K1=1×1030
2H2(g)+O2(g)
2H2O(g) K2=2×1081
2CO2(g)
2CO(g)+O2(g) K3=4×10-92
以下说法正确的是 ( )
A.常温下,NO分解产生O2的反应的平衡常数表达式为K1=c(N2)·c(O2)
B.常温下,水分解产生O2,此时平衡常数的数值约为5×10-80
C.常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2
D.以上说法都不正确
难度: 简单查看答案及解析
-
能正确反映出N2+3H2
2NH3,△H<0的关系的是( )
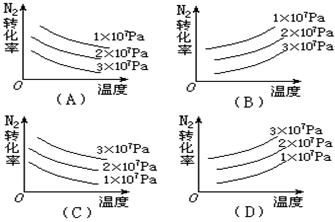
难度: 简单查看答案及解析
-
某同学按下图所示的装置进行电解实验。下列说法正确( )
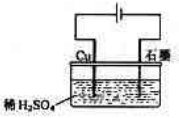
A.电解过程中,铜电极上有H2产生
B.电解过程中,铜电极不断溶解
C.电解过程中,石墨电极上始终有铜析出
D.整个电解过程中,H+的浓度不断增大
难度: 简单查看答案及解析
-
进行如下实验,在A锥形瓶中放入10g块状CaCO3,在B锥形瓶中放入5g粉末状CaCO3,分别加入50mL2mol/L盐酸。下图中能正确表示实验结果的是( )
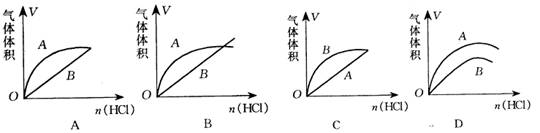
难度: 简单查看答案及解析
-
一定条件下,对于可逆反应X(g)+3Y(g)
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol/L、0.3 mol/L、0.08 mol/L,则下列判断正确的是 ( )
A.c1∶c2=3∶1
B.平衡时,Y和Z的生成速率之比为2∶3
C.c1的取值范围为0.04 mol/L<c1<0.14 mol/L
D.X、Y的转化率相等
难度: 简单查看答案及解析
-
将CoCl2溶解于盐酸中可以形成CoCl42—,在溶液中存在下面的化学平衡:
Co2+(aq)+4Cl-(aq)
CoCl42—(aq) ΔH>0
粉红色 蓝色
下列说法正确的是 ( )
A.升高温度,正反应速率增大,逆反应速率减小
B.该反应的平衡常数
C.将盛有CoCl2和盐酸混合液的试管置于热水中,试管内溶液为红色
D.增大Cl-浓度,平衡向正反应方向移动,Co2+、Cl-浓度都减小
难度: 简单查看答案及解析
-
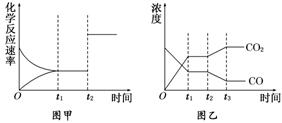
图1为某化学反应的速率与时间的关系示意图。下列有关t1时刻改变条件的说法正确的是 ( )
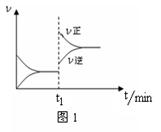
A.2SO2(g)+O2(g)
2SO3(g) ΔH<0,t1时刻升高温度
B.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) ΔH<0,t1时刻增大O2浓度
C.H2O(g)+CO(g)
H2(g)+CO2(g) ΔH>0, t1时刻增大压强
D.C(s)+H2O(g)
CO(g)+H2(g) ΔH>0,t1时刻升高温度
难度: 简单查看答案及解析
-
某温度下,向容积为2 L的密闭反应器中充入0.10 mol SO3,当反应器中的气体压强不再变化时测得SO3的转化率为20%,则该温度下反应2SO2(g)+O2(g)
2SO3(g)的平衡常数为( )
A.3.2×103 B.1.6×103 C.8.0×102 D.4.0×102
难度: 简单查看答案及解析
-
在1L密闭容器中加入2molA和1molB,在一定温度下发生下列反应:
2A(g)+B(g)
3C(g)+D(g),达到平衡时容器内D的百分含量为a%。若保持容器体积和温度不变,分别通入下列几组物质达到平衡时容器内D的百分含量也为a%的是( )
A.3molC和1molD
B. 4molC和1molD
C.2molA、1molB和3molC
D.1.9molA、0.95molB、0.15molC和 0.05molD
难度: 简单查看答案及解析
-
反应4A(s)+3B(g)
2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
难度: 简单查看答案及解析
-
微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别为Ag2O和Zn,电解质溶液为KOH,电极反应为:Zn+2OH--2e- = ZnO+H2O, Ag2O+H2O+2e- =2Ag+2OH-,总反应式为:Ag2O+ Zn = 2Ag+ZnO。根据上述反应式,下列说法正确的是( )
A.在使用过程中,电池负极区溶液的碱性增强
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn电极发生还原反应,Ag2O电极发生氧化反应
难度: 简单查看答案及解析
-
合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:
 N2(g)+3H2(g)
N2(g)+3H2(g) 2NH3(g) 673K,30MPa下n(NH3)和n(H2)随时间变化的关系如下图所示。下列叙述正确的是( )
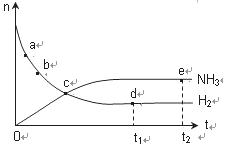
A.点a的正反应速率比点b的大
B.点 c处反应达到平衡
C.点d (t1时刻) 和点 e (t2时刻) 处n(N2)不一样
D.其他条件不变,773K下反应至t1时刻,n(H2)比上图中d点的值大
难度: 简单查看答案及解析
-
观察下列几个装置示意图,有关叙述正确的( )
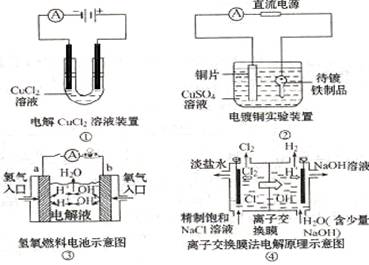
A.装置①中阳极上析出红色固体
B.装置②的待镀铁制品应与电源正极相连
C.装置③闭合电键后,外电路电子由a极流向b极
D.装置④的离子交换膜允许阳离子、阴离子、水分子自由通过
难度: 简单查看答案及解析
-
T℃时,A气体与B气体反应生成C气体。反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )
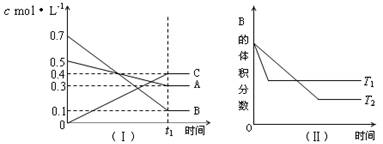
A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B. t1+10)min时,保持容器总压强不变,通入稀有气体,平衡向逆反应方向移动
C.T℃时,在相同容器中,若由0.3mol·L—1 A 0.1 mol·L—1 B和0.4 mol·L—1 C反应,达到平衡后,C的浓度仍为0.4 mol·L—1
D.其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大
难度: 简单查看答案及解析
-
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是 ( )
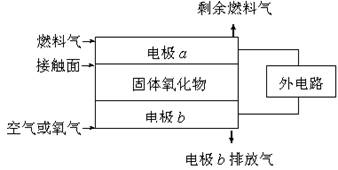
A.电极b为电池负极,电极反应式为O2+4e-=4O2-[
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为C2H4+6O2--12e-=2CO2+2H2O
难度: 简单查看答案及解析
-
相同容积的四个密闭容器中,进行同样的可逆反应2A (g) +B(g)
3C(g)+2D(g) ,起始时四个容器内所装A、B的量如下:
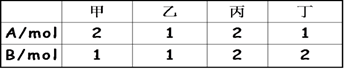
在相同温度下建立平衡时,A或B的转化率α的大小关系为( )
A、A的转化率:甲<丙<乙<丁 B、A的转化率:甲<乙<丙<丁
C、B的转化率:甲>乙>丙>丁 D、B的转化率:丁>乙>丙>甲
难度: 简单查看答案及解析
-
反应4A(s)+3B(g)
2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
难度: 简单查看答案及解析
-
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:aA(g)+B(g)
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 ( )
A.a=3 B.a=2
C.B的转化率为40% D.B的转化率为60%
难度: 简单查看答案及解析