-
在下列变化:①大气固氮,②硝酸银分解,③实验室制取氨气。按氮元素被氧化、被还原、既不被氧化又不被还原的顺序排列正确的是
A.①②③ B.②①③ C.③②① D.③①②
难度: 简单查看答案及解析
-
下列有关物质的性质与用途有对应关系的是
A.Si有良好的半导体性能,可以用于。
B.氨气具有还原性,可用作制冷剂
C.Na2O2呈浅黄色,可用作潜水艇中的供氧剂
D.明矾水解形成Al(OH)3胶体,可用作水处理中的净水剂
难度: 简单查看答案及解析
-
下列有关NA的说法正确的是
A.标准状况下,将2.24L Cl2溶于水,可得到HC1O分子的数目是0.lNA
B.NA个Fe(OH)3胶体粒子的质量为107g
C.8.0gCu2S和CuO的混合物中含有铜原子数为0.lNA
D.2.3gNa与氧气完全反应,反应中转移的电子数介于0.lNA到0.2NA之间
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.在0.01mol/LBa(OH)2溶液中:Al3+、NH4+、NO3-、HCO3-
B.0.1 mol/L的FeCl2溶液中:H+、Al3+、SO42-、ClO-
C.滴加KSCN溶液显红色的溶液:NH4+、K+、Cl-、I-
D.由水电离产生的c(H+)=l×l0-3mol/L的溶液中:Na+、B a2+、NO3-、Cl-
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.NaAl(SO4)2溶液中滴加Ba(OH)2直至SO42-沉淀完全:
2Al3++ 6OH-+ 3SO42-+ 3Ba2+= 2Al(OH)3↓+3BaSO4↓
B.NH4HS溶液与少量的NaOH溶液反应:NH4++ OH-= NH3·H2O
C.稀H2SO4和Na2S2O3溶液共热:S2O32-+2H+=SO2↑+S↓+H2O
D.过量Cl2通入FeI2溶液中:3C12+2I-+ 4Fe2+= 4C1-+I2+4Fe3+
难度: 简单查看答案及解析
-
下列实验能达到实验目的是
A.检验淀粉的水解是否水解完全,取水解后的溶液加入I2观察溶液是否变蓝色。
B.苯的溴代反应,用溴水与苯混和加入铁粉
C.Fe(NO3)2中Fe2+的检验是在Fe(NO3)2中加入稀硫酸后加入KMnO4溶液,观察Fe(NO3)2溶液是否褪色。
D.铝热反应的实验中,将氧化铁与铝粉混合后,插入用砂纸打磨的镁条,用燃烧的小木条点燃镁条。
难度: 中等查看答案及解析
-
下列实验对应的现象及结论均正确且两者具有因果关系的是
选项
实验
现象
结论
A
将SO2通入BaCl2溶液,然后滴入稀硝酸
白色沉淀,白色沉淀不溶于稀硝酸
所得沉淀为BaSO3,后转化BaSO4
B
浓硫酸滴入蔗糖中,并搅拌
得黑色蓬松的固体并有刺激性气味气体
该过程中浓硫酸仅体现吸水性和脱水性
C
向FeCl2溶液中加入足量FeI2出现红褐色沉淀和无色气体
出现红褐色沉淀和无色气
FeCl2溶液部分变质
D
向足量含淀粉的FeI2溶液中滴加2滴氯水
溶液变蓝
还原性:I->Fe2+
难度: 中等查看答案及解析
-
实验室里利用以下反应制取少量氮气:NaNO2+NH4Cl=NaCl+N2↑+2H2O。关于该反应的下列说法正确的是
A.N2既是氧化产物又是还原产物
B.每生成1 mol N2转移电子的物质的量为6 mol
C.NH4Cl中的氮元素被还原
D.NaNO2是还原剂
难度: 简单查看答案及解析
-
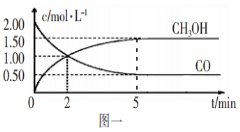
已知H2O2在催化剂作用下分解速率加快,进程的变化示意图。下列说法正确的是
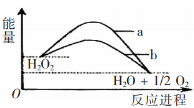
A.加入催化剂,可提高H2O2的平衡转化率
B.a表示的催化剂效率高于b表示的催化剂效率
C.改变催化剂.既能改变反应热.也能改变活化能
D.该反应可自发进行
难度: 简单查看答案及解析
-
有机物M的结构简式如图所示.下列谠法中正确的是

A.M中不含有手性碳原子
B.M中所有碳原子均可能在同一平面
C.M可以发生加成、取代、消去等反应
D.1mol M常温下最多可以与3 mol NaOH反应
难度: 简单查看答案及解析
-
有机物甲是一种含有一个六元环结构的化合物,其分子式为C7H12O2,在酸性条件下可以发生水解,且水解产物只有一种,又知甲的分子中含有两个甲基,则甲的可能结构有
A.6种 B.10种 C.11种 D.12种
难度: 简单查看答案及解析
-
某固体混合物可能由Al2(NH4)2SO4、MgCl2、FeCl2、AlC13中的两种或多种组成,现对该混合物做如下实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。关于该固体混合物,下列说法正确的是

A.一定含有Al,其质量为4.5g
B.一定不含FeCl2,可能含有MgCl2和AIC13
C.一定含有MgCl2和FeCl2
D.一定含有(NH4)2SO4和MgCl2,且物质的量相等
难度: 困难查看答案及解析
-
工业生产硫酸中二氧化硫的催化氧化原理为:2SO2(g)+O2(g)
2SO3(g),反应混合体系在平衡状态时SO3的百分含量与温度的关系如下图所示。下列说法错误的是
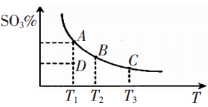
A.在A、B、C三点时,V(正)=v(逆),在D点时V(正)>v(逆)
B.A、B、C三点的平衡常数一定不相同
C.升高温度可以加快化学反应速率,有利于平衡向正反应方向移动
D.一定温度下,保持容器体积不变,向平衡体系中通人稀有气体,压强增大,平衡不移动
难度: 简单查看答案及解析
-
常温下,向20mL 0.2mol/LH2A溶液中滴加0.2 mol/L NaOH溶液。有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)所示。根据图示判断,下列说法正确的是
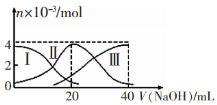
A.当V(NaOH)=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
B.等浓度的NaOH溶液与H2A溶液按体积2:1混合后,其溶液中水的电离程度比纯水大
C.NaHA溶液中:c(OH-)=c(H+)+c(HA-)+2c(H2A)
D.向上述加入20 mL NaOH溶液后所得溶液中再加入水的过程中,pH可能减少
难度: 简单查看答案及解析
-
我国“蛟龙”号载人潜水器进行第五次下潜试验,最大深度达到7062米,并安全返同。其动力电源是Al-Ag2O电池,原理如图所示。下列说法中正确的是

A.Al电极是该电池的正极
B.Ag在Ag2O/Ag电极上发生氧化反应
C.该电池负极反应是 2A1-6e-+8OH-=2AlO2-+4H2O
D.Ag2O/Ag电极附近溶液中的pH减小
难度: 中等查看答案及解析
-
FeS与一定浓度的HNO3反应,生成Fe(NO3)3、Fe2(SO4)3、NO2、N2O4、NO和H2O,当NO2、N2O4、NO的物质的量之比为1:1:1时,实际参加反应的FeS与HNO3的物质的量之比为
A. 1:6 B.1:7 C.2:11 D.16:25
难度: 中等查看答案及解析
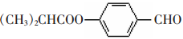 ;合成M的一种途径如下:
;合成M的一种途径如下: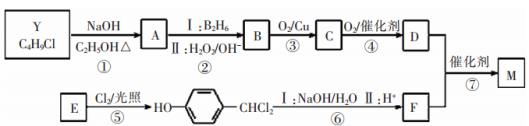
 ;
;
 )
)