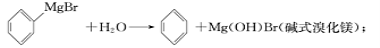-
运用有关概念判断下列叙述正确的是
A.1molH2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.
和
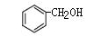 互为同系物
互为同系物D.BaSO4的水溶液不导电,故BaSO4是弱电解质
难度: 中等查看答案及解析
-
某学习兴趣小组讨论辨析以下说法,其中说法正确的是
①通过化学变化可以实现16O与18O间的相互转化
②灼烧钠的化合物时,火焰呈黄色,发生化学反应
③碱性氧化物一定是金属氧化物
④只由一种元素组成的物质一定为纯净物
⑤石墨和C60是同素异形体
⑥糖类、蛋白质、油脂属于天然高分子化合物
A.③⑤⑥ B.①② C.③⑤ D.①③④
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,33.6 L氟化氢中含有氟原子的数目为1.5NA
B.常温常压下,7.0 g乙烯与丙烯的混合物中含有碳氢键的数目为NA
C.50 mL 18.4 mol/L浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D.某密闭容器盛有0.1 mol N2和0.3 mol H2,在一定条件下充分反应,转移电子的数目为0.6NA
难度: 中等查看答案及解析
-
下列各组离子能在指定环境中大量共存的是
A.在c(HCO3-)=0.1 mol/L的溶液中:NH4+、AlO2-、Cl-、NO3-
B.在由水电离出的c(H+)=1×10-12 mol/L的溶液中:Fe2+、ClO-、Na+、SO42-
C.在加入铝粉产生H2的溶液中:SO42-、NO3-、Na+、NH4+
D.在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+
难度: 中等查看答案及解析
-
下列物质中,既能导电又属于强电解质的一组物质是
A.熔融MgCl2、熔融NaOH
B.液氨、石灰水
C.石墨、食醋
D.稀硫酸、蔗糖
难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是
A.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:Mn2++C1O-+H2O=MnO2↓+C1-+2H+
B.用稀硝酸清洗做过银镜反应的试管:Ag+NO3-+4H+=Ag++NO↑2H2O
C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4C1-
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:2C1-+2H2O
H2↑+Cl2↑+2OH-
难度: 中等查看答案及解析
-
下列说法正确的是
A.石油分馏、煤的气化、海水制食盐、蛋白质变性等过程都包含化学变化
B.酸性氧化物一定不能和酸反应
C.稀豆浆、硅酸、氯化铁溶液均为胶体
D.爆鸣气、铝热剂、玻璃、花生油、聚乙烯均为混合物
难度: 中等查看答案及解析
-
除去下列物质中所含的少量杂质的方法正确的是

A.① B.② C.③ D.④
难度: 中等查看答案及解析
-
按以下实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。
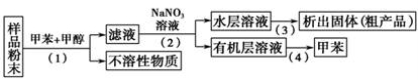
下列说法错误的是
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
难度: 中等查看答案及解析
-
向CuSO4溶液中逐滴加入KI溶液至过量,观察到产生白色沉淀CuI,蓝色溶液变为棕色。再向反应后的溶液中通入过量的SO2气体,溶液变成无色。则下列说法正确的是
A.通入22.4 L SO2参加反应时,有2 NA个电子发生转移
B.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
C.滴加KI溶液时,KI被氧化,CuI是氧化产物
D.上述实验条件下,物质的氧化性:Cu2+>I2>SO2
难度: 中等查看答案及解析
-
下列关于物质或离子检验的叙述正确的是
A.在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+,无Fe2+
B.气体通过无水硫酸铜,粉末变蓝,证明原气体中含有水蒸气
C.灼烧白色粉末,火焰成黄色,证明原粉末中有Na+,无K+
D.将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
难度: 中等查看答案及解析
-
在CO2中,Mg燃烧生成MgO和C。下列说法正确的是
A.元素C的单质只存在金刚石和石墨两种同素异形体
B.Mg、MgO中镁元素微粒的半径:r(Mg2+)>r(Mg)
C.在该反应条件下,Mg的还原性强于C的还原性
D.该反应中化学能全部转化为热能
难度: 中等查看答案及解析
-
烃A分子式为C4H10,分子结构中含有一个次甲基(
),则此物质A的二溴代物的种数为
A、3种 B、4种 C、5种 D、以上都不对
难度: 中等查看答案及解析
-
工业上将Na2CO3和Na2S以1:2的物质的量之比配成溶液,再通入SO2,可制取Na2S2O3,同时放出CO2。在该反应中
A.硫元素在此过程中仅被还原
B.氧化剂与还原剂的物质的量之比为1:2
C.每生成1molNa2S2O3,转移4mo l电子
D.相同条件下,每吸收10m3SO2就会放出2.5m3CO2[
难度: 中等查看答案及解析
-
用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项
①中物质
②中物质
预测②中的现象
A
稀盐酸
碳酸钠与氢氧化钠的混合溶液
立即产生气泡
B
浓硝酸
用砂纸打磨过的铝条
产生红棕色气体
C
氯化铝溶液
浓氢氧化钠溶液
产生大量白色沉淀
D
草酸溶液
高锰酸钾酸性溶液
溶液逐渐褪色
难度: 中等查看答案及解析
-
在反应:11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4中,15molCuSO4可氧化磷原子的物质的量为
A.1/5mol B.2mol C.3 mol D.6mol
难度: 中等查看答案及解析


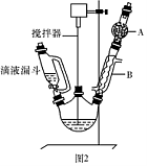
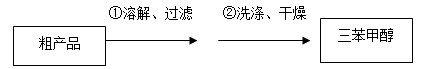
 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇的流程如图1所示,装置如图2所示。