-
温家宝总理在2010年政府工作报告中提出,要大力开发低碳技术,推广高效节能技术.下列有关做法与此不相符的是( )
A.关停CO2排放量大的化工企业,切断CO2的源头
B.利用工业生产产生的二氧化碳制造全降解塑料
C.开发新能源,如太阳能、风能等,减少对化石能源的依赖
D.鼓励购买小排量汽车,推广电动、混合动力汽车难度: 中等查看答案及解析
-
下列有关说法或表示正确的是( )
A.2一甲基苯酚结构式:
B.碳化钙的电子式:Ca2+
C.铁在潮湿的空气中腐蚀,正极的电极反应式:Fe-2e-═Fe2+
D.188O2-粒子结构示意图:难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.在含有4mol Si-O键的石英晶体中,氧原子的数目为2NA
B.常温常压下,2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA
C.标准状况下,1L辛烷完全燃烧后,所生成气体产物的分子数为
D.0.1L 2 mol•L-1的(NH4)2S溶液中含有的S2-数目为0.2NA难度: 中等查看答案及解析
-
下列装置或操作不能达到实验目的是( )
A.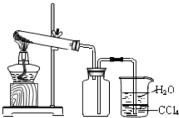
实验室制取并收集NH3
B.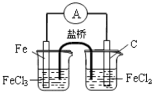
构成原电池
C.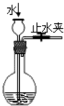
检查装置气密性
D.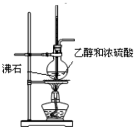
实验室制备乙烯难度: 中等查看答案及解析
-
下列各组离子,一定能在指定环境中大量共存的是( )
A.在含有大量I-离子的溶液中:Cl¯、Fe3+、Al3+、Cu2+
B.在使pH试纸变红的溶液中:Fe2+、Na+、SO42-、ClO-
C.在由水电离出的c(H+)=10-12 mol•L-1的溶液中:Na+、Ba2+、Cl¯、Br¯
D.在加入Al能放出大量H2的溶液中:NH4+、SO42¯、Cl¯、HCO3¯难度: 中等查看答案及解析
-
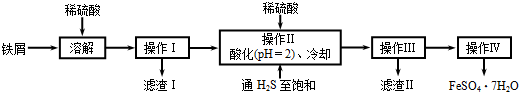
铅的冶炼大致过程如下:①富集:将方铅矿(PbS)进行浮选;②焙烧:2PbS+3O2
2PbO+2SO2;③制粗铅:PbO+C
Pb+CO;PbO+CO
Pb+CO2.下列说法正确的是( )
A.浮选法富集方铅矿的过程属于化学变化
B.方铅矿焙烧反应中,PbS是还原剂,还原产物只有PbO
C.整个冶炼过程中,制取1molPb共转移2mol电子
D.将1molPbS冶炼成Pb理论上至少需要6g碳难度: 中等查看答案及解析
-
香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍.下列说法错误的是( )
A.原子半径:Y>Z>R>T
B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物碱性:X>Z
D.XR2、WR2两化合物中R的化合价相同难度: 中等查看答案及解析
-
下列化学实验能达到目的是( )
A.用激光笔检验某KI溶液中是否溶有淀粉
B.加入适量溴水后过滤,可除去苯中的少量苯酚
C.向碘水中加入苯或酒精,均可从碘水中萃取碘
D.向AgCl沉淀中滴加少量KI溶液,可说明Ksp(AgCl)<Ksp (AgI)难度: 中等查看答案及解析
-
已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去).则W、X不可能是( )选项 W X A 盐酸 Na2CO3溶液 B Cl2 Fe C CO2 Ca(OH)2溶液 D NH3•H2O AlCl3溶液
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列化学实验事实及其解释都正确的是( )
A.在漂白粉中滴入70%的硫酸,立刻产生黄绿色气体,说明硫酸具有还原性
B.久置的酚酞试液有白色沉淀(未变质),加入少量酒精,沉淀消失,说明酚酞易溶于酒精
C.硫酸铜溶液中加入KI溶液,有白色沉淀生成,再加入四氯化碳振荡,四氯化碳层呈紫色,说明白色沉淀为CuI2
D.在淀粉溶液中加入适量稀硫酸微热,再加少量新制氢氧化铜浊液加热,无红色沉淀,说明淀粉未水解难度: 中等查看答案及解析
-
下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3-
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-Mn2++2H2O+Cl2↑
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+难度: 中等查看答案及解析
-
利用下图所示的有机物X可生产S-诱抗素Y.下列说法正确的是( )
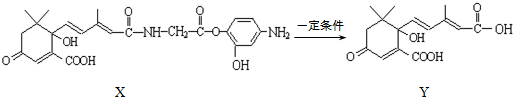
A.X结构中有2个手性碳原子
B.Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
C.X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐
D.1 molX与足量NaOH溶液反应,最多消耗5 mol NaOH,1 molY最多能加成4 molH2难度: 中等查看答案及解析
-
T℃时在2L密闭容器中使X(g)与Y(g)发生反应生成Z(g).反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的转化率与时间的关系如图2所示.则下列结论正确的是( )
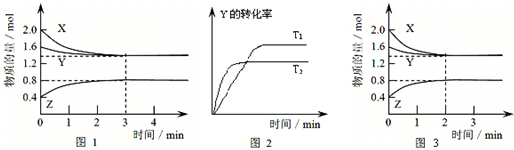
A.容器中发生的反应可表示为:3X(g)+Y(g)⇌2Z(g)
B.反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是( )
A.25℃时,pH=4.75、浓度均为0.1mol•L-1的CH3COOH、CH3COONa混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
B.在0.1 mol•L-1 NaHSO3溶液中有c(Na+)+c(H+)═c(HSO3-)+c(SO32-)+c(H2SO3)
C.Na2CO3溶液:c(OH-)-c(H+)═c(HCO3-)+2c(H2CO3)
D.物质的量浓度相等的Na2CO3和NaHCO3溶液等体积混合后的溶液中:3c(H2CO3)+2c(H+)+c(HCO3-)═2c(OH-)+c(CO32-)难度: 中等查看答案及解析