-
下列有关生活中化学叙述正确的是
A.双氧水可在医疗上做消毒杀菌剂
B.提倡使用乙醇汽油主要是为了提高汽油的燃烧效率
C.纤维素和蛋白质水解的最终产物均为葡萄糖
D.变质的油脂具有难闻的特殊气味,是由于油脂发生了水解反应
难度: 中等查看答案及解析
-
下列各组离子在相应的条件下一定能够大量共存的是
A. 遇到KSCN变血红色的溶液:Cl-、I-、Mg2+、Fe2+
B. 加入甲基橙试剂变红的溶液:SO42-、Br-、NH4+、Na+
C. 在25℃时,由水电离出的c(OH-)=10-11的溶液:Al3+、K+、NO3-、F-
D. 含有大量的ClO-离子的溶液:OH-、S2-、Ca2+、Na+
难度: 中等查看答案及解析
-
下列用来表示物质变化的离子方程式中,正确的是
A.明矾加入到氢氧化钡溶液中使硫酸根离子恰好沉淀
Al3+ + SO42- + Ba2+ + 4OH- = AlO2- + BaSO4↓+ 2H2O
B.铁加入到过量的稀硝酸溶液中:3Fe + 8H+ + 2NO3- = 3Fe2+ + 2NO↑ + 4H2O
C.乙醛的银镜反应:CH3CHO+2Ag(NH3)2+ +2OH-
CH3COO-+NH4+ + 2Ag↓+3NH3↑+ H2O
D.向碳酸氢铵溶液中加入过量的氢氧化钠溶液:NH4+ + OH- = NH3·H2O
难度: 中等查看答案及解析
-
下列大小比较正确的是
A. 接受H+的能力:CH3COO-> HCO3- >ClO-
B. 25℃时,pH=3的硫酸溶液中水的电离程度大于pH=11的氨水溶液中水的电离程度
C. 0.1mol/L的(NH4)2CO3溶液中c(NH4+)等于0.1mol/L的NH4Cl溶液中c(NH4+)的2倍
D. 四氯化碳分子中的键角大于白磷分子中的键角
难度: 中等查看答案及解析
-
用惰性电极电解1L的某浓度的氯化钠溶液,一段时间后,停止电解。此时若加入100g36.5%的浓盐酸,所得溶液恰好与原溶液完全相同。下列说法正确的是
A. 电解过程中,阴阳两极产生的气体体积相同(同温同压时)
B. 电解后的溶液中c(NaOH)=1mol/L
C. 电解过程中,转移电子的物质的量约为8mol
D. 原溶液中含有117g NaCl
难度: 中等查看答案及解析
-
2010年1月份以来,海南豇豆在武汉白沙洲农副产品市场连续三次被检测出含有禁用农药水胺硫磷。水胺硫磷的结构如下,下列有关该物质的性质描述不正确的是
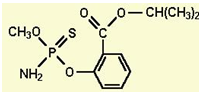
A. 该物质不溶于水,能溶于乙醚、苯、丙酮等有机溶剂
B. 该物质能发生取代反应、加成反应
C. 该物质能与NaOH溶液反应,每1mol该物质最多消耗3mol NaOH
D. 该物质苯环上的一卤代物共有4种
难度: 中等查看答案及解析
-
向m g镁、铜合金中加入稀硝酸溶液至合金恰好完全溶解(设硝酸的还原产物只有NO),向所得溶液中加入物质的量浓度为2 mol/L的NaOH溶液至沉淀达到最大值,产生沉淀的质量为(m + n)g,则下列有关叙述中不正确的是
A. 若n=5.1,则m的值可能为9.8
B. 若n=5.1,则参加反应的硝酸的物质的量为0.4 mol
C. 若n=5.1,则加入的NaOH溶液的体积为150 mL
D. 若n=5.1,则被还原的硝酸的物质的量为0.1 mol
难度: 中等查看答案及解析