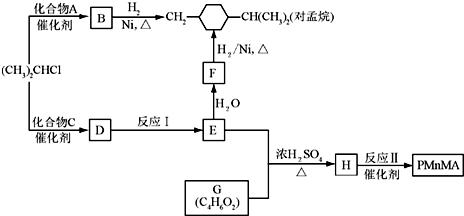
-
已知33As、35Br位于同一周期.下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4>H2SO4>H3PO4难度: 中等查看答案及解析
-
下列用品的有效成分及用途对应错误的是( )
A B C D 用品 



有效成分 NaCl Na2CO3 Al(OH)3 Ca(ClO)2 用途 做调味品 做发酵粉 做抗酸药 做消毒剂
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列解释实验现象的反应方程式正确的是( )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗:2Na+O2═Na2O2
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-═Ag2S↓+2Cl-
C.Na2O2在潮湿的空气中放置一段时间,变成白色黏稠物:2Na2O2+2CO2═2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀:2HCO+Ca2++2OH-═CaCO3↓+CO
+2H2O
难度: 中等查看答案及解析
-
下列试验中,所选装置不合理的是( )
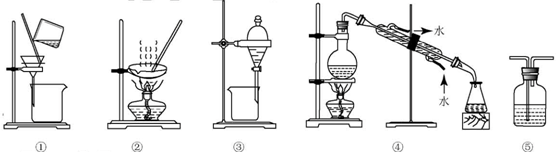
A.分离Na2CO3溶液和CH3COOC2H3,选④
B.用CCl4提取碘水中的碘,选③
C.用FeCl2,溶液吸收Cl2选⑤
D.粗盐提纯,选①和②难度: 中等查看答案及解析
-
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
① ② ③ A 淀粉KI溶液 浓硝酸 无明显变化 B 酚酞溶液 浓盐酸 无明显变化 C AlCl3溶液 浓氨水 有白色沉淀 D 湿润红纸条 饱和氯水 红纸条褪色 
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
下列说法正确的是( )
A.天然植物油常温下一般呈液态,难溶于水,有恒定的熔点、沸点
B.麦芽糖与蔗糖的水解产物均含葡萄糖,故二者均为还原型二糖
C.若两种二肽互为同分异构体,则二者的水解产物不一致
D.乙醛、氯乙烯和乙二醇均可作为合成聚合物的单体难度: 中等查看答案及解析
-
人工光合作用能够借助太阳能,用CO2和H2O制备化学原料.下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是( )
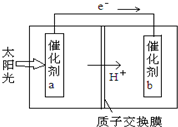
A.该过程是将太阳能转化为化学能的过程
B.催化剂a表面发生氧化反应,有O2产生
C.催化剂a附近酸性减弱,催化剂b附近酸性增强
D.催化剂b表面的反应是CO2+2H++2e一═HCOOH难度: 中等查看答案及解析