-
下列有关说法中正确的是( )
A.近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造更好的晶体管
D.纤维素在人体内可水解为葡萄糖,是人类重要的营养物质之一
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c( H+)= 1xl0-13 mol/L的溶液中: K+、Na+、SiO32-、SO42-
B.1.0 mol/L的CH3COOH溶液:K+、Fe3+、NO3﹣、Cl﹣
C.在c(OH﹣)/c(H+)=1×1012的溶液:NH4+、Ca2+、C1﹣、K+
D.甲基橙显黄色的溶液:Na+、CO32﹣、NO3﹣、SO32﹣
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X、Y、Z、W原子的最外层电子数之和为18,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构。下列说法正确的是( )
A.单质的沸点:Y>Z
B.X、Y、Z三种元素不可能形成离子化合物
C.X的最高价氧化物对应的水化物的酸性比W的强
D.Y分别与Z、W形成的化合物中化学键类型不相同
难度: 中等查看答案及解析
-
下列图示且与对应的叙述不相符的是( )

A.图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB溶液的pH
B.图2表示 KNO3 的溶解度曲线,a点所示的溶液是80℃时KNO3的不饱和溶液
C.图3 表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
D.图4表示恒温恒容条件下,2NO2(g)
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
难度: 困难查看答案及解析
-
下表中的实验操作能达到实验目的的是( )
选项
实验操作
实验目的
A
将浓硫酸和碳单质混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊
检验气体产物中CO2的存在
B
将NaOH的乙醇溶液加入溴乙烷中,加热,将产生的气体直接通入到酸性高锰酸钾溶液中,溶液褪色
证明溴乙烷的消去反应有乙烯生成
C
先滴入Ba(NO3)2溶液,产生沉淀,加入足量稀盐酸,仍有沉淀
检验溶液中是否含有SO42-
D
常温下测定物质的量浓度相同的盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH
证明相同条件下,在水中HCl电离程度大于CH3COOH
难度: 中等查看答案及解析
-
乙酸橙花酯是一种食用香料,其结构简式如右图所示,关于该有机物的下列叙述中不正确的是( )
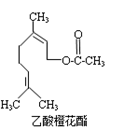
①分子式为C12H20O2 ②能使酸性KMnO4溶液褪色,但不能使溴水褪色
③能发生的反应类型有:加成、取代、氧化、加聚
④它的同分异构体中可能有芳香族化合物,且属于芳香族化合物的同分异构体有8种
⑤1mol该有机物水解时只能消耗1molNaOH
⑥1mol该有机物在一定条件下和H2反应,共消耗H2为3mol
A.①②③ B.①②⑤ C ②④⑥ D.②⑤⑥
难度: 中等查看答案及解析
-
以葡萄糖为燃料的微生物燃料电池结构示意图如图所示.关于该电池的叙述不正确的是( )

A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e-=6CO2+24H+
C.放电过程中,质子(H+)从负极区向正极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体22.4 L
难度: 中等查看答案及解析
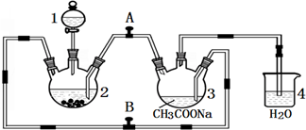



 则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:
则用CH4(g)和H2O(g)反应制得H2(g)和CO(g)的热化学方程式为:
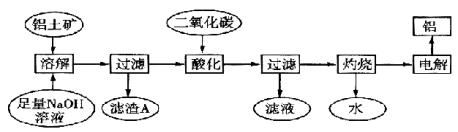
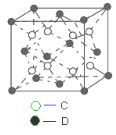
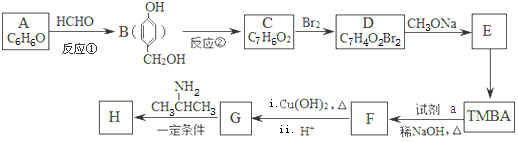
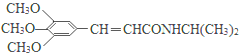 )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):