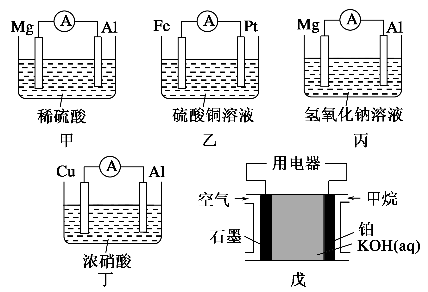
-
下列有关电池的说法不正确的是( )
A.手机上用的锂离子电池属于二次电池
B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极
C.甲醇燃料电池可把化学能转化为电能
D.锌锰干电池中,锌电极是负极
难度: 中等查看答案及解析
-
已知空气-锌电池的电极反应:
锌片:Zn-2OH--2e-=ZnO+H2O,
石墨:1/2O2+H2O+2e-=2OH-
据此推断锌片是( )
A.负极,被氧化 B.负极,被还原
C.正极,被氧化 D.正极,被还原
难度: 中等查看答案及解析
-
目前,科学家提出了一种经济而且理想的获得氢能源的循环体系(如图)。关于此循环体系,下列说法中错误的是( )
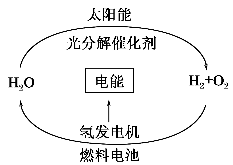
A.燃料电池能够使化学反应产生的能量转化为电能
B.燃料电池中通入H2的一极作负极,发生氧化反应
C.在此循环中发生了反应:2H2O2H2↑+O2↑
D.目前化学家急需解决的问题是寻找合适的光照条件下分解水的催化剂
难度: 中等查看答案及解析
-
如图为氢氧燃料电池示意图,按此图的提示,下列叙述不正确的是( )

A.a电极是负极
B.b电极的电极反应为:4OH--4e-=2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
难度: 中等查看答案及解析
-
一种燃料电池中发生的化学反应为:在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是( )
A.CH3OH(g)+O2(g)-2e-=H2O(l)+CO2(g)+2H+(aq)
B.O2(g)+4H+(aq)+4e-=2H2O(l)
C.CH3OH(g)+H2O(l)-6e-=CO2(g)+6H+(aq)
D.O2(g)+2H2O(l)+4e-=4OH-
难度: 中等查看答案及解析
-
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法中不正确的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.负极发生的反应是Zn+2OH--2e-=Zn(OH)2
C.工作时,负极区溶液碱性减弱,正极区溶液碱性增强
D.溶液中OH-向正极移动,K+、H+向负极移动
难度: 中等查看答案及解析
-
一种新型燃料电池,一极通入空气,另一极通入丁烷气体;电解质是掺杂氧化钇(Y2O3)的氧化锆(ZrO2)晶体,它在熔融状态下能传导O2-。下列对该燃料电池的说法中,正确的是( )
A.在熔融的电解质中,O2-由负极移向正极
B.电池的总反应是:2C4H10+13O2=8CO2+10H2O
C.通入空气的一极是正极,电极反应为O2+4e-=2O2-
D.通入丁烷的一极是正极,电极反应为C4H10+26e-+13O2-=4CO2+5H2O
难度: 中等查看答案及解析
-
有一新型燃料电池,是用两根金属做电极插入KOH溶液中,然后向X极通入CH4,向Y极通入O2,关于此燃料电池的说法错误的是( )
A.通入CH4的X极是负极,通入O2的Y极是正极
B. 放电一段时间后,电解质溶液中KOH的物质的量不变
C.在标准状况下,通入5.6 LO2,完全反应时有1.0 mol电子转移
D.放电时,通入甲烷一极附近的pH升高
难度: 中等查看答案及解析
-
碱性电池具有容量大,放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)
下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为2MnO2(s)+H2O(l)+2e-=
Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过0.2 mol电子,锌的质量理论上减少6.5 g
难度: 中等查看答案及解析
-
我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,空气中的氧气与铝反应产生电流。电池总反应为4Al+3O2+6H2O=4Al(OH)3,下列说法不正确的是( )
A.正极反应式为O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大与氧气的接触面积
D.该电池通常只需要换铝板就可以继续使用
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:
3Zn+2K2FeO4+8H2O
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.放电时正极反应为:FeO42-+4H2O+3e-=Fe(OH)3+5OH-
C.放电时每转移3 mol电子,正极有1 mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
难度: 中等查看答案及解析