-
下列有关原子结构和元素周期律的表述正确的是
①原子序数为15的元素的最高化合价为+3
②ⅦA族元素是同周期中非金属性最强的元素
③第二周期ⅣA族元素的原子核电荷数和中子数一定为6
④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A. ①② B. ①③ C. ②④ D. ③④
难度: 中等查看答案及解析
-
下列说法正确的是
A. 原子的L层上的电子数为奇数的元素一定是主族元素
B. 同一周期的IIA族和IIIA族元素的原子序数之差一定为1
C. 相邻两个周期的同一主族元素的原子序数之差等于上一周期所含元素种类
D. 主族序数等于周期序数的元素一定为金属元素
难度: 中等查看答案及解析
-
下列叙述正确的是
A.汽油、柴油和植物油都属于烃
B.乙醇既能被氧化为乙醛,也能被氧化为乙酸
C.苯与溴水在Fe3+催化下发生取代反应生成溴苯
D.硫酸铜溶液和硫酸铵溶液均可使蛋白质溶液变性
难度: 中等查看答案及解析
-
下列化学用语书写正确的是
A.氯离子的结构示意图:
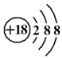
B.作为相对原子质量测定标准的碳核素:
C
C.氯化镁的电子式:
D.用电子式表示氯化氢分子的形成过程:
难度: 中等查看答案及解析
-
下列说法正确的是
A.共价化合物中可能含有离子键
B.Ca2+、K+、Cl-、S2-四种离子的离子半径依次减小
C.
Po、
Po、
Po三种原子的核外电子数分别为124、125、126
D.第VIA族元素氧、硫、硒对应的氢化物H2O、H2S、H2Se的稳定性依次减弱
难度: 中等查看答案及解析
-
有德国重离子研究中心人工合成的第112号元素的正式名称为“Copernicium”,相应的元素符号位“Cn”。该元素的名称是为了纪念天文学家哥白尼而得名。该中心人工合成Cn的过程可表示为:
Zn+
Pb=
Cn+
n
下列叙述中正确的是
A.
Cn的原子核内中子数比质子数多53
B. Cn元素的相对原子质量为277
C. 上述合成过程中属于化学变化
D. Cn元素位于元素周期表的第六周期,是副族元素
难度: 中等查看答案及解析
-
下列各组物质中性质的变化规律排列正确的是
A. 微粒半径:Al3+>Mg2+>Na+>F-
B. 稳定性:HI>HBr>HCl>HF
C. 酸性:HClO4>H2SO4>H3PO4>H4SiO4
D. 碱性:Ca(OH)2>KOH>Mg(OH)2>Al(OH)3
难度: 中等查看答案及解析
-
“嫦娥一号”的四大科学目标之一是探测下列14种元素在月球上的含量和分布:K、Th(钍)、U(铀)、O、Si、Mg、Al、Ca、Fe、Ti(钛)、Na、Mn、Cr(铬)、Gd(钆),其中属于主族元素的有
A. 4种 B. 5种 C. 6种 D. 7种
难度: 中等查看答案及解析
-
门捷列夫在描述元素周期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X的性质的描述中正确的是
A. X单质易与水反应
B. X形成的氧化物易与水反应生成酸
C. X易形成氧化物XO
D. XH4的稳定性比SiH4的低
难度: 中等查看答案及解析
-
下列说法正确的是
A.2—甲基丙烷的八氯取代物有三种
B.
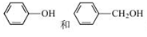 互为同系物
互为同系物C.顺—2—丁烯与反—2—丁烯与氢气加成的产物不相同
D.
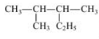 的名称为2—甲基—3—乙基丁烷
的名称为2—甲基—3—乙基丁烷难度: 中等查看答案及解析
-
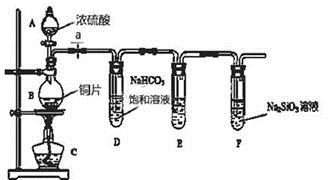
为说明氯比硫的非金属性强,下列事实可作依据的是
A. HCl的溶解性强于H2S
B. 氯的最高价为+7价
C. H2S中的S2-能被Cl2氧化
D. HClO的氧化性强于H2SO4
难度: 中等查看答案及解析
-
X元素最高价氧化物对应的水化物为H2XO3,它的气态氢化物为
A. HX B. H2X C. XH3 D. XH4
难度: 中等查看答案及解析
-
四种主族元素的离子aXm+、bYn+、cZn-和dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则对下列叙述的判断正确的是
①a-b=m-n
②元素的原子序数a>b>c>d
③元素非金属性Z>R
④最高价氧化物对应水化物的碱性X>Y
A. ②③ B. ③ C. ①②③④ D. ①②③
难度: 中等查看答案及解析
-
同主族元素所形成的同一类化合物,其结构和性质往往相似,化合物PH4I是一种无色晶体,下列对它的描述中错误的是
A. 它是共价化合物
B. 在加热时,它能分解
C. 它能跟碱发生反应
D. 它可由PH3和HI化合而成
难度: 中等查看答案及解析
-
下列有关物质结构的说法正确的是
A.78 g Na2O2晶体中所含阴、阳离子个数为3NA
B.3.4 g氨气中含有0.6NA个N—H键
C.Na2O2的电子式为:

D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
难度: 中等查看答案及解析
-
下列事实不能作为实验判断依据的是
A.钠和镁分别与冷水反应,判断钠和镁的金属活动性强弱
B.在MgCl2与AlCl3溶液中分别加入过量的氨水,判断镁与铝的金属活动性强弱
C.硫酸和硅酸钠溶液反应出白色沉淀,判断硫与硅的非金属活动性强弱
D.Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱
难度: 中等查看答案及解析