-
下列说法不正确的是( )
A. 服用铬含量超标的药用胶囊会对人对健康造成危害
B. 食用一定量的油脂能促进人体对某些维生素的吸收
C.CH4和Cl2在光照条件下反应的产物最多可能有四种
D.无论乙烯的加成,还是乙烯使酸性KMnO4溶液褪色,都与分子内含有碳碳双键有关
难度: 中等查看答案及解析
-
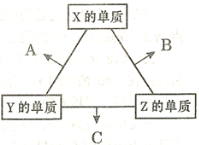
有X、Y、Z、W、M五种短周期元素,其中X、Y、Z、W同周期,Z、M同主族;X+与M2-具有相同的电子层结构;离子半径:Z2->W-;Y的单质晶体熔点高、硬度大,是一种重要的半导体材料。下列说法中,正确的是( )
A.X、M两种元素只能形成X2M型化合物
B.由于W、Z、M元素的氢气化物相对分子质量依次减小,所以其沸点依次降低
C.元素Y、Z、W的单质晶体属于同种类型的晶体
D.元素W和M的某些单质可作为水处理中的消毒剂
难度: 中等查看答案及解析
-
下列各图所示装置,肯定不符合气密性要求的是( )

难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1L0.1mol·L-1的氨水中有NA个NH4+
B.常温常压下,8gO2含有4NA个电子
C.标准状况下,22.4L三氯甲烷含有NA个分子
D.1molNa被完全氧化生成Na2O2,失去2NA电子
难度: 中等查看答案及解析
-
由Fe2O3、Fe、CuO、C、Al中的几种物质组成的混合粉末,取样品进行下列实验(部分产物略去)。关于混合粉末的组成判断正确的是

A.一定含CuO和C B.一定含Fe2O3、CuO和C
C.一定含CuO和C,一定不含Al D.气体Z为纯净物
难度: 中等查看答案及解析
-
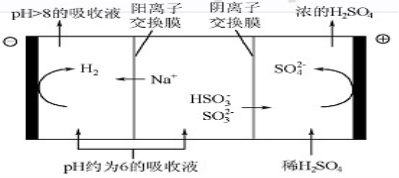
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )

A.燃料电池工作时,正极反应为:O2 + 2H2O + 4e- === 4OH-
B.若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
难度: 中等查看答案及解析
-
已知25℃时,电离常数Ka(HF)=3.6×10-4,溶度积常数Ksp(CaF2)=1.46×10-10。现向1 L 0.2mol·L-1HF溶液中加入1 L 0.2 mol·L-1CaCl2溶液,则下列说法中,正确的是( )
A.25℃时,0.1 mol·L-1HF溶液中pH=1 B.Ksp(CaF2)随温度和浓度的变化而变化
C.该体系中有CaF2沉淀产生 D.加入CaCl2溶液后体系中的c(H+)浓度不变
难度: 中等查看答案及解析