-
下列事实不能用电化学理论解释的是 ( )
A.轮船水线下船壳上装有一定数量的锌块 B.粗锌比纯锌制H2更快
C.镀锌铁比镀锡铁耐用 D.银质奖章长期放置后表面会变暗
难度: 简单查看答案及解析
-
下列有关化学反应热的描述中,正确的是 ( )
①化学反应过程中一定有能量变化; ②△H>0表示放热反应,△H<0表示吸热反应;③△H的大小与热化学方程式中的化学计算数成正比;④放热反应在常温下就一定能进行;⑤生成物的总能量小于反应物总能量时,△H<0; ⑥化学反应中放出的热才是反应热;
A.①③⑤ B.②④⑥ C.①②③ D.④⑤⑥
难度: 简单查看答案及解析
-
据报道,科学家正在研究用容量更大的锌电池取代铅蓄电池,其电池反应式为
2Zn + O2== 2ZnO,原料是锌料、电解质溶液、空气。下列叙述中正确的是 ( )
A.Zn是电池的正极 B.负极反应:Zn —2e--== Zn2+
C.正极发生氧化反应 D.电解质溶液应选择稀硫酸
难度: 简单查看答案及解析
-
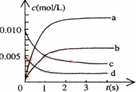
在四个不同容器中,在不同条件下进行合成氨的反应,根据下列在相同时间内测定的结果判断,生成氨的速率最快的是 ( )
A.v(H2)= 0.1 mol·L—1·min—1 B. v(N2)= 0.1 mol·L—1·min—1
C. v(N2)= 0.2 mol·L—1·min—1 D. v(NH3)= 0.3 mol·L—1·min—1
难度: 简单查看答案及解析
-
一个容积固定密闭容器中进行反应:N2 + 3H2 2NH3,一定达到平衡状态的是 ( )
①1个N≡N键断裂的同时,有3个H — H键形成;②1个N≡N键断裂的同时,有6个N — H键形成;③N2的体积分数不再改变;④容器的压强不再改变;⑤容器内气体的密度不再改变;
A.①③④ B.①②④ C.①③⑤ D.②③④
难度: 简单查看答案及解析
-
下列一定能说明酸HX是弱电解质的是 ( )
①常温下NaX溶液的PH大于7;②HX溶液做导电实验,灯泡很暗;③HX不与NaCl反应;④0.1mol/L的HX溶液的PH = 2;⑤HX具有很强的挥发性;⑥PH = 1的HX加水稀释成10倍后,PH = 1.5
A. ②③⑤ B.①④⑥ C.①②④⑥ D.①②③④⑤⑥
难度: 简单查看答案及解析
-
以惰性电极电解CuSO4溶液,若阳极上产生气体的物质的量为0.01mol,则阴极上析出的铜的质量为 ( )
A.0.64g B.1.28g C.2.56g D.5.12g
难度: 简单查看答案及解析
-
用石墨作电极电解CuSO4溶液,通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的 ( )
A.CuSO4 B.H2O C.CuO D.CuSO4·5H2O
难度: 简单查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是 ( )
①纯银器表面在空气中因化学腐蚀渐渐变暗②当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用③在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法④可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
A.①② B.②③ C.③④ D.①③
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是 ( )
A.钢铁在潮湿的空气中易生锈
B. Fe(SCN)3溶液中加入固体KSCN后颜色加深
C.实验室可用排饱和食盐水的方法收集氯气
D.室温下,将1mLpH=3的醋酸溶液加水稀释至100mL后,测得其pH<5
难度: 简单查看答案及解析
-
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ。且氧气中1 mol O=O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463kJ,则氢气中1 mol H—H键断裂时吸收热量为 ( )
A.920 kJ B.557 kJ C.436 kJ D.188 kJ
难度: 简单查看答案及解析
-
将PH = 1的盐酸平均分成2份,1份加适量水,另一份加入与盐酸物质的量浓度相等的NaOH溶液后,PH均变成了2,则加入的水与NaOH溶液的体积比为 ( )
A.9 B.10 C.11 D.12
难度: 简单查看答案及解析
-
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如右图所示,有关说法正确的是 ( )
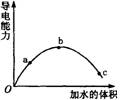
A a、b、c三点溶液的pH:a>b>c
B 若用湿润的pH试纸测量c处溶液的pH,比实际pH偏小
C a、b、c三点溶液用1mol/L氢氧化钠溶液中和,消耗氢氧化钠溶液体积:a>b>c
D a、b、c三点溶液醋酸的电离度:c>b>a
难度: 简单查看答案及解析
-
使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s) + 1/2O2(g)=CO(g) △H=-Q1kJ/mol,CO(g) + 1/2O2(g)=CO2(g) △H=-Q2kJ/mol与这些焦炭完全燃烧相比较,损失的热量是 ( )
A、1/2Q2 kJ B、1/3Q2 kJ C、1/3(Q1 + Q2)kJ D、1/3Q1 kJ
难度: 简单查看答案及解析
-
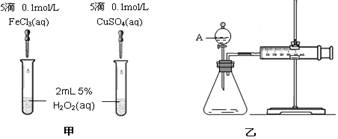
某同学按右图所示的装置进行电解实验。下列说法正确的是 ( )
A.电解过程中,铜电极上有H2产生
B.电解一定时间后,石墨电极不可能有铜析出
C.电解初期,主反应方程式为:Cu + H2SO4
CuSO4 + H2↑
D.整个电解过程中,H+的浓度不断增大
难度: 简单查看答案及解析
-
用阳极X和阴极Y电解Z的水溶液,电解一段时间,再加入W,能使溶液恢复到电解前的状态,符合题意的组是
( )
组号
X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
CuSO4
CuSO4溶液
C
C
C
H2SO4
H2O
D
Ag
Fe
AgNO3
AgNO3晶体
难度: 简单查看答案及解析
-
一定温度下将amol PCl5充入一容积固定密闭容器中达到如下平衡:PCl5(g)
PCl3(g)+Cl2(g),此时压强为P1;再向容器中通入amol PCl5,在同温下又达到平衡时的压强为P2,则下列说法中正确的是 ( )
A 2P1>P2 B 2P1=P2 C 2P1<P2 D P1=P2
难度: 简单查看答案及解析
-
某恒温恒容的容器中,建立如下平衡:2A(g)
B(g),在相同条件下,若分别再向容器中通入一定量的A气体或B气体,重新达到平衡后,容器内A的体积分数比原平衡时 ( )
A 都增大 B 都减小 C 前者增大后者减小 D 前者减小后者增大
难度: 简单查看答案及解析
-
取浓度相同的Na0H和HCl溶液,以3∶2 体积比相混合,所得溶液的pH 等于12,则原溶液的浓度为 ( )
A.0.01mol/L B.0.017mol/L C.0.05mol/L D.0.50mol/L
难度: 简单查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g) ΔH﹥0,下列图象中正确的是 ( )
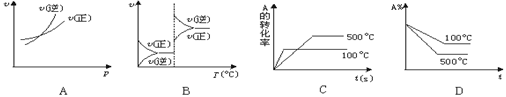
难度: 简单查看答案及解析
-
右图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加一滴石蕊溶液。下列实验现象中正确的是 ( )

A.逸出气体的体积,a电极的小于b电极的
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
难度: 简单查看答案及解析
-
在相同温度和压强下,对反应CO2(g) + H2(g)
CO(g) + H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表,四种情况达到平衡后,n (CO)的大小顺序是 ( )
CO2
H2
CO
H2O
甲
a mol
a mol
0 mol
0 mol
乙
2a mol
a mol
0 mol
0 mol
丙
0 mol
0 mol
a mol
a mol
丁
a mol
0 mol
a mol
a mol
A.乙=丁>丙=甲 B.乙>丁>甲>丙 C.丁>乙>丙=甲 D.丁>丙>乙>甲
难度: 简单查看答案及解析
-
在可逆反应mA(g)+nB(g)
pC(g);△H<0中m、n、p为系数,且m+n>p。分析下列各图,在平衡体系中A的质量分数与温度t℃、压强P关系正确的是 ( )
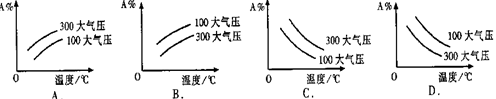
难度: 简单查看答案及解析
-
在373K时,把0.5molN2O4气体通入体积为5L(恒容)的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达到平衡,此时容器内压强为反应前的1.6倍。下列说法不正确的是 ( )
A.前2s,N2O4的平均反应速率为0.005mol·L-1·s-1
B.平衡时,N2O4的转化率为60%
C.平衡时,体系内NO2为0.04mol·L-1
D.在2s时,体系内压强为反应前的1.1倍
难度: 简单查看答案及解析
-
市场上经常见锂离子电池,它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
Li + 2Li0.35NiO2
2Li0.5NiO2。下列说法不正确的是 ( )
A.放电时,负极的电极反应式:Li — e- = Li+
B.该电池不能用水溶液作为电解质
C.充电时,Li0.5NiO2既发生氧化反应又发生还原反应
D.放电过程中Li+向负极移动
难度: 简单查看答案及解析