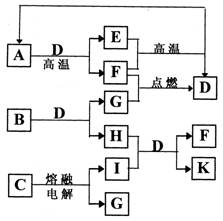
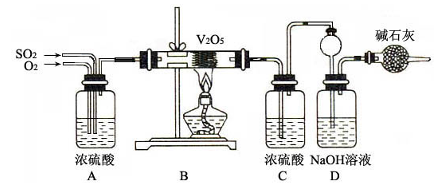
-
下列说法正确的是
A.光纤有广泛的用途.制造光纤的主要材料是单质硅
B.氢氧化钠、碳酸氢钠、氢氧化铝都可用作抗酸药
C.甲醛的水溶液具有杀菌、防腐的作用,可用于海产品保鲜
D.水垢中含有的硫酸钙可用饱和碳酸钠溶液处理,使之转化为碳酸钙
难度: 简单查看答案及解析
-
下列说法中正确的是
A.原子中,质量数一定大于质子数
B.自然界中有多少种核素,就有多少种原子
C.由两种元素组成的化合物,若含有离子键,就没有共价键
D.电子层多的原子半径一定大于电子层少的原子半径
难度: 简单查看答案及解析
-
下列叙述中,不正确的是
A.质量和密度都相同的H2和N2,所占有的体积相同
B.体积和密度都相同的CO和N2,所含有的原子数目相同
C.2.24LCO2气体完全被Na2O2吸收,转移的电子数为0.1NA(NA为阿伏加德罗常数)
D.等物质的量的甲基(—CH3)和羟基(—OH)所含的电子数相等
难度: 简单查看答案及解析
-
已知某溶液中存在较多的H+、Cl—,则溶液中还可能大量存在的离子组是
A.Al3+、NH4+、Br— B.Na+、Fe2+、NO3—
C.Na+、AlO2—、SO42— D.Ag+、Fe3+、NO3—
难度: 简单查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是
A.0.1mol/LCH3COONa溶液:c(Na+)=c(CH3COO—)
B.0.1mol/L NaHCO3溶液:c(Na+)>c(HCO3—)>c(OH—)>c(H+)>c(CO32—)
C.由NH4Cl与NH3· H2O组成的碱性溶液:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
D.向NaCl溶液中滴加盐酸得到pH=2的混合溶液:c(Na+)+c(H+)=c(Cl—)
难度: 简单查看答案及解析
-
一定温度下,1molX和n mol Y在容积为2L的密闭容器中发生如下反应:
X(g)+Y(g)
Z(g)+M(s),5min后达到平衡,此时生成a mol Z。下列说法正确的是
A.向平衡后的体系中加入1mol M,平衡向逆反应方向移动
B.用X表示此反应的反应速率是(0.1—0.1a)mol·(L·min)—1
C.向上述平衡体系中再充入1molX,v(正)增大,v(逆)减小,平衡正向移动
D.当混合气体的质量不再发生变化时,说明反应达到平衡状态
难度: 简单查看答案及解析
-
Fe3+、SO42-、A13+和X四种离子以物质的量之比2:4:1:1大量共存于同一溶液中,X可能是
A.Na+ B.OH- C.CO32- D.C1-
难度: 简单查看答案及解析
-
用两支惰性电极插入500mL
溶液中,通电电解,当电解液的pH从6.0变为3.0时(电解质溶液电解前后体积的变化忽略不计),则电极上应析出的银的质量是
A.54mg B.81mg C.108mg D.216mg
难度: 简单查看答案及解析