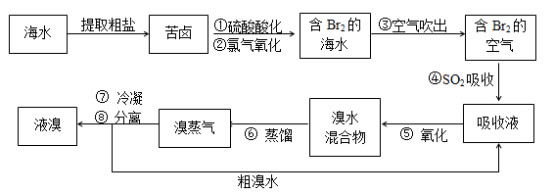
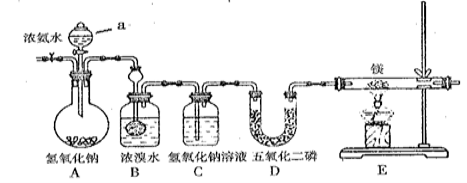
-
化学与生活、社会密切相关。下列说法错误的是
A.亚硝酸盐属于实物防腐剂,可以适当地添加于食物中
B.氨气泄漏时,可喷洒大量的水以减少氨气的扩散
C.漂白粉在空气中不稳定,可用于漂白纸张
D.大量燃烧化石燃料是造成雾霾天气的重要原因
难度: 简单查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是
A.Na2O2是碱性氧化物,能与CO2、H2O反应作供氧剂
B.浓硫酸具有强氧化性,常温下可用铝罐盛装
C.SO2和Cl2均具有漂白性,两者混合使用可以增强漂白效果
D.氯气具有酸性,可与烧碱或石灰乳反应制取含氯消毒剂
难度: 简单查看答案及解析
-
下列实验过程中,始终无明显现象的是
A.CO2通入饱和碳酸钠溶液中
B.在稀硫酸中加入铜粉,再加入KNO3固体
C.NO2通入FeSO4溶液中
D.SO 2通入饱和CaCl2溶液中
难度: 简单查看答案及解析
-
下列叙述正确的是
A.非金属氧化物一定不是碱性氧化物
B.HCl、H2S、NH3都是电解质
C.漏斗、蒸馏烧瓶、分液漏斗、滴定管等仪器用于物质分离
D.Fe(OH)3、FeCl2、CuS都不能直接用化合反应制备
难度: 简单查看答案及解析
-
在探究氯水成分的实验中,下列根据实验现象得出的结论错误的是
实验序号
实验现象
实验结论
A
氯水呈浅绿色
氯水中含有含有Cl2
B
向FeCl2溶液中滴加氯水,溶液变成棕黄色
氯水中含有HClO
C
向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀
氯水中含有Cl-
D
向氯水中加入NaHCO3粉末,有气泡产生
氯水中含有H+
难度: 简单查看答案及解析
-
设
为阿伏伽德罗常数的值。下列说法正确的是
A.5.6g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA
B.7.8gNa2S和Na2O2中含有的阴离子数大于0.1NA
C.50mL18.4mol/L浓硫酸与足量铜加热反应,生成
分子的数目为0.46NA
D.常温常压下,46g的NO2和N2O4混合气体含有的原子数为3NA
难度: 中等查看答案及解析
-
常温下,下列各组离子或分子在指定分散系中一定能大量共存的是
A.
的溶液中:
、
、
、
B.氢氧化铁胶体中:
、
、
、
C.在
的溶液中:
、
、
、
D.水电离产生的
的溶液中HCO3-、
、
、
难度: 中等查看答案及解析
-
下列离子方程式中,正确的是
A.次氯酸钙溶液中通入过量CO2:Ca2++2ClO-+H2O+CO2═CaCO3↓+2HClO
B.用碳酸钠溶液吸收少量的二氧化硫:
C.用食醋除去水垢中的
:
D.
溶液与过量的
溶液反应:
难度: 中等查看答案及解析
-
下列实验中所选用的仪器或实验基本操作合理的是
①用50 mL量筒量取5.2 mL稀硫酸 ②用酒精洗涤粘有硫粉的试管 ③用托盘天平称量10.1g氯化钠晶体 ④实验中不慎将手指划破,可立即用FeCl3溶液止血 ⑤用瓷坩埚熔融NaOH ⑥用饱和NaHCO3溶液除去CO2中的少量SO2
A.①②③④ B.③④⑥ C.③④⑤ D.③⑤⑥
难度: 简单查看答案及解析
-
中学常见物质A、B、C、D存在下图转化关系(部分生成物和反应条件略去)。该转化关系中A可能是下列物质中的
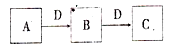
①金属钠 ②硫单质 ③NH3 ④Na2CO3 ⑤AlCl3溶液 ⑥单质铁
A.3 B.4 C.5 D.6
难度: 困难查看答案及解析
-
下列关于某溶液所含离子检验的方法和结论正确的是
A.加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,说明有Ca2+
B.通入少量Cl2后,溶液变为黄色,再加入淀粉溶液后,溶液变蓝,说明有I-
C.加入盐酸产生能使澄清石灰水变浑浊的气体,则原溶液中一定有CO32-或SO32-
D.往溶液中加入BaCl2溶液和稀HNO3,有白色沉淀生成,说明一定有SO42-
难度: 简单查看答案及解析
-
反应①、②分别是从海藻灰和某种矿石中提取碘的主要反应:
①2NaI+MnO2+3H2SO4═2NaHSO4+MnSO4+2H2O+I2
②2NaIO3+5NaHSO3═2Na2SO4+3NaHSO4+H2O+I2
下列说法正确的是( )
A.两个反应中均为硫元素被氧化
B.碘元素在反应①中被还原,在反应②中被氧化
C.氧化性:MnO2>SO42->IO3->I2
D.反应①、②中生成等量的I2时转移电子数比为1:5
难度: 中等查看答案及解析
-
等质量的下列物质与足浓盐酸反应(必要时可加热),放出Cl2物质的量最多的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列实验能达到相应目的的是
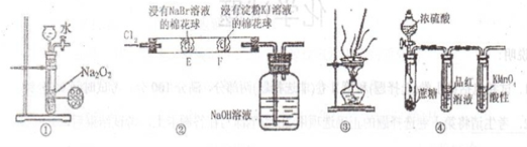
A.用图①装置制备少量的氧气
B.用图②可证明氧化性
C.用图③装置将海带灼烧成灰
D.用图④装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
难度: 中等查看答案及解析
-
某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解19.2g(已知硝酸只被还原为NO气体).向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示.下列分析或结果错误的是( )
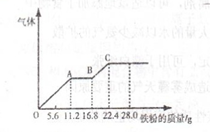
A.混合酸中NO3-物质的量为2mol•L-1
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.混合酸中H2SO4 的物质的量的浓度为2.5mol
难度: 困难查看答案及解析
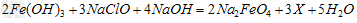 ①高铁酸钠主要通过如下反应制取:
①高铁酸钠主要通过如下反应制取: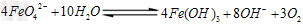 ②高铁酸钠在水中可以发生如下反应:
②高铁酸钠在水中可以发生如下反应: