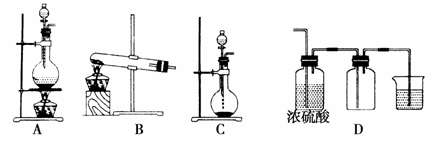
-
APEC会址选择在雁栖湖作为主会场是为了彰显绿色环保的理念,为此要大力开发低碳技术,推广高效节能技术,积极发展新能源和可再生能源。下列有关做法与此不相符的是
A.在西部和沿海地区兴建风力发电站,解决能源问题
B.回收废弃的饮料包装纸,制作成公园内的休闲长椅
C.大力开发丰富的煤炭资源,减少对石油的依赖
D.鼓励购买小排量汽车,推广电动、混合动力汽车
难度: 简单查看答案及解析
-
乳制品富含钙,紫菜富含铁.这里的“钙”和“铁”指的是
A.分子 B.元素 C.单质 D.氧化物
难度: 简单查看答案及解析
-
下列关于物质分类的说法正确的是
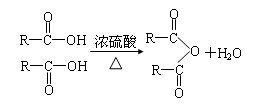
A.油脂、糖类、蛋白质均是天然高分子化合物
B.三氯甲烷、氯乙烯、三溴苯酚均是卤代烃
C.CaCl2、烧碱、聚苯乙烯均为化合物
D.稀豆浆、硅酸、雾霾均为胶体
难度: 简单查看答案及解析
-
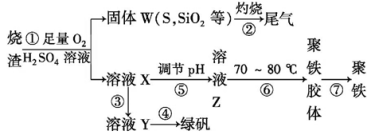
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、Mg2+、Al3+、AlO2-、SiO32-、NO3-、CO32-。某同学收集了该地区的雾霾,经必要的预处理后得试样X溶液,设计并完成了如下的实验:
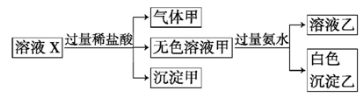
下列判断正确的是
A.沉淀甲是硅酸和硅酸镁的混合物
B.Na+、AlO2-和SiO32-一定存在于溶液X中
C.气体甲一定是纯净物
D.CO32-和NO3-一定不存在于溶液X中
难度: 中等查看答案及解析
-
短周期元素X、Y、W、R的原子序数依次增大。 元素X是形成化合物种类最多的元素,Y、R同主族,R原子的最外层电子数是内层电子总数的一半, W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
A.X、W、R的最高价氧化物的水化物酸性强弱顺序是X<W<R
B.气态氢化物的稳定性:Y>R
C.X、Y、W、R的原子半径由大到小的顺序为R﹥ W﹥ X﹥Y
D.X、W的氧化物由固态转化为气态时,克服相同的作用力
难度: 中等查看答案及解析
-
足量铜与一定量的浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体2.24L(标准状况),这些气体与一定体积O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是50 mL,下列说法正确的是
A.参加反应的硝酸是0.4mol
B.消耗氧气的体积为1.68 L
C.此反应过程中转移的电子为0.3 mol
D.混合气体中含NO21.12 L
难度: 困难查看答案及解析
-
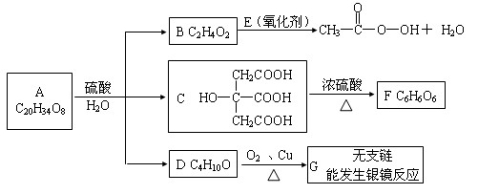
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下转化关系:
。下列有关物质的推断不正确的是
A.若甲为Cl2,则丁可能是铁
B.若甲为NH3,则丁可能是氧气
C.若甲为AlCl3溶液,则丁可能是氨水
D.若甲为NaOH,则丁可能是SO2
难度: 中等查看答案及解析