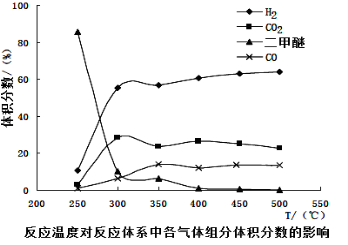
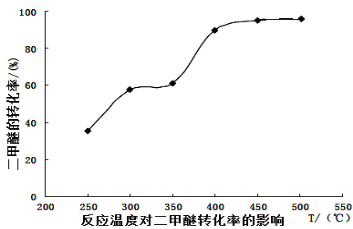
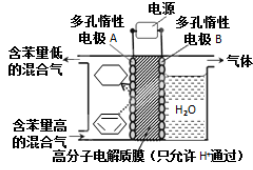
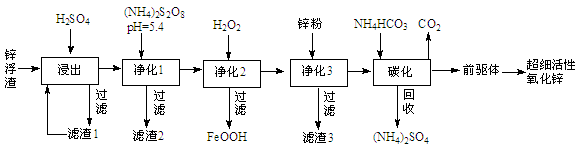
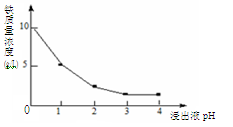
-
化学与生产、生活密切相关。下列叙述正确的是
A.使用含有氯化钠的融雪剂会加快桥梁的腐蚀
B.“海水淡化”可以解决“淡水供应危机”,向海水中加入净水机明矾可以使海水淡化
C.煤经过气化、液化等物理变化可得到清洁燃料
D.棉花、羊毛、木材和草类的主要成分都是纤维素
难度: 中等查看答案及解析
-
已知NA代表阿伏加德罗常数,下列说法正确的是
A.1mol铁与铝的混合物与足量稀硫酸反应时,转移电子数是3NA
B.18g重水(D2O)含有的电子数为9NA
C.pH=2的醋酸加水稀释到10倍后,溶液中H+ 数目大于0.001NA
D.标准状况下,NA个CH3OH分子的体积约是22.4L
难度: 中等查看答案及解析
-
下列微粒可以大量共存于同一溶液中的是
A.Na+、NH4+、AlO2—、SiO32- B.Ca2+、NH4+、NH3﹒H2O、CH3COO-
C.Cr2O72-、H+、C2H5OH、NO3— D.Cu2+、SO42- 、HS—、Cl—
难度: 中等查看答案及解析
-
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项
陈述Ⅰ
陈述Ⅱ
A
硝酸和氨水能溶解Ag2O
Ag2O是两性氧化物
B
HCl与Na2SO3溶液反应生成SO2
用饱和Na2SO3溶液除去SO2中的少量HCl
C
苯分子中不存在碳碳双键
苯不能被酸性KMnO4氧化
D
向CaCl2溶液中通入CO2产生白色沉淀
CaCO3是难溶物
难度: 中等查看答案及解析
-
X、Y、Z、W、T五种元素,其中X、Y、Z、T在周期表中的相对位置如下表,X元素的单质是空气中含量最多的成分。W的单质有毒气体,常用于自来水的消毒杀菌,下列说法正确的是
A.原子半径:T>W>Z
B.元素T与X的原子序数相差15
C.T、Z、W三种元素的最高价氧化物对应的水化物的酸性依次减弱
D.X、W两元素的氢化物的浓溶液相互靠近时有白烟产生
难度: 中等查看答案及解析
-
某小组利用下列装置进行电化学实验,下列实验操作及预期现象正确的是

A.X和Y与电流表连接,Cu极为正极,发生氧化反应
B.X和Y与电流表连接,盐桥中的阴离子移向CuSO4溶液
C.X和Y分别与电源“—”、“+”极相连,Cu极质量减轻
D.X和Y分别与电源“+”、“—”极相连,Zn极电极反应为4OH——4e-=O2↑+2H2O
难度: 中等查看答案及解析
-
下列实验装置设计正确、且能达到目的的是
编号
A
B
C
D
实验
方案


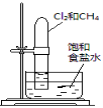
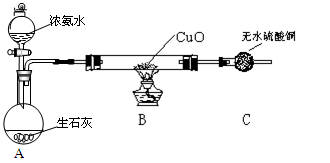
置于光亮处
实验
目的
收集氨气及并进行
尾气吸收
制取乙炔并验证炔烃
的性质
验证AgCl沉淀可转化为
溶解度更小的Ag2S沉淀
验证甲烷与氯气发生化学反应
难度: 中等查看答案及解析
-
室温下,将0.2 mol·L-1的一元酸HA和0.1 mol·L-1的NaOH溶液等体积混合后,溶液显碱性,下列说法不正确的是
A.0.1mol·L-1 HA溶液与0.1 mol·L-1的NaOH溶液中,水电离出来的c(H+)相等
B.混合后溶液中:c(HA)>c(Na +)>c(A-)>c(OH-)
C.混合后溶液中:c(A-) + c(HA)=0.2 mol·L-1
D.混合后溶液中:c(Na+) + c(H+)=c(A-) + c(OH-)
难度: 中等查看答案及解析