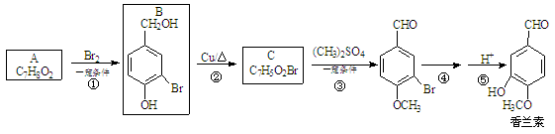
-
化学环境、材料、信息、能源关系密切,下列说法不正确的是
A.利用催化设施,可以将汽车尾气中CO和NO转化为无害气体
B.将“地沟油”蒸馏可以获得汽油
C.对废旧电池进行回收处理主要是为了防止重金属污染水源
D.半导体行业中有一句话:“从沙滩到用户”,说明计算机芯片的材料是硅
难度: 中等查看答案及解析
-
下列关于有机化合物的性质说法正确的是
A.棉花和蛋白质都是高分子化合物,水解产物相同
B.苯和乙烯都能使溴水褪色,均与溴水发生加成反应
C.乙酸乙酯和油脂互为同系物
D.甲烷和乙醇均能发生取代反应
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列有关说法正确的是
A.标准状况下,22.4 LCH4和CH3CH2OH的混合物所含分子数为NA
B.常温常压下,16 g14CH4所含中子数目为8 NA
C.0.2 mol的Na2O2和水完全反应转移的电子数为0.2 NA
D.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA
难度: 中等查看答案及解析
-
下列实验能达到相应目的的是
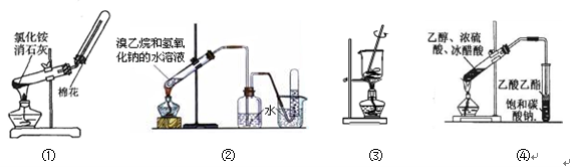
A.用图①装置制取并收集氨气 B.用图②装置制取和收集乙烯
C.用图③装置将海带灼烧成灰 D.用图④装置制取乙酸乙酯
难度: 中等查看答案及解析
-
下列有关物质的性质和该性质的应用均正确的是
A.氯气具有酸性,可与烧碱或石灰乳反应制备含氯消毒剂
B.浓硫酸具有强氧化性,常温下可用铝罐盛装
C.氢氟酸具有弱酸性,可用氢氟酸雕刻玻璃
D.过氧化钠具有强氧化性,可用作潜水艇中氧气的来源
难度: 中等查看答案及解析
-
已知:N2(g)+3H2(g)
2NH3(g);△H=-92.4 kJ/mol,下列结论正确的是
A.在密闭容器中加入1 molN2(g)和3 molH2(g)充分反应放热92.4 kJ
B.N2(g)+3H2(g)
2NH3(l);△H=-Q kJ/mol ,则Q>92.4
C.增大压强,平衡向右移动,平衡常数增大
D.若一定条件下反应达到平衡,N2的转化率为20%,则H2的转化率一定为60%
难度: 中等查看答案及解析
-
已知X、Y、Z、W四种短周期元素在周期表中的相对位置如图所示,下列说法正确的是
A.非金属性:Z<X<Y
B.W的原子序数可能是Y的原子序数的2倍
C.气态氢化物稳定性:Y<W
D.四种元素中不可能有金属元素
难度: 中等查看答案及解析
-
对常温下0.1 mol/L的醋酸溶液,以下说法正确的是
A.由水电离出来的的c(H+)=1.0×10-13 mol/L
B.c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-)
C.与同浓度的盐酸分别加水稀释10倍后:pH(醋酸)>pH(盐酸)
D.与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO-)=0.1 mol/L
难度: 中等查看答案及解析